题目内容
1.已知碳碳单键可以绕键轴旋转,关于结构简式可表示为的烃,下列说法中正确的是( )
| A. | 分子中至少有4个碳原子处于同一直线上 | |
| B. | 该烃苯环上的一氯代物有4种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
分析 A、根据苯环中处于对角的2个碳原子、2个氢原子共线判断;
B、根据等效氢原子判断;
C、常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,此基础上进行判断;
D、苯的同系物指含有1个苯环,侧链为烷基.
解答 解:A、苯环中处于对角的2个碳原子、2个氢原子共线,则该分子中至少有6个碳原子处于同一直线上,故A错误;
B、该烃中含有3种氢原子,该烃的一氯代物有3种,故B错误;
C、甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面.两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面,由于甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,所以至少有10个碳原子共面,故C正确;
D、该有机物含有2个苯环,不是苯的同系物,故D错误.
故选C.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
相关题目
12.下面用轨道表示式表示原子的价电子排布正确的是( )
| A. |  | B. | 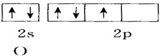 | ||
| C. | 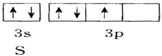 | D. | 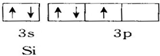 |
16.某温度下反应H2(g)+I2(g)?2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1I2(g)及0.3mol•L-1HI(g),则下列说法中正确的是( )
| A. | 反应正好达平衡 | |
| B. | 反应向左进行 | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应向某方向进行一段时间后c(H2)<0.2 mol•L-1 |
6.水的电离过程为H2O?H++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述中正确的是( )
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液pH:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为1.45×10-7 mol/L |
13.对于CCl2F2(商品名称是氟利昂-12),下列有关叙述正确的是( )
| A. | 有两种同分异构体 | B. | 是非极性分子 | ||
| C. | 只有一种结构,无同分异构体 | D. | 是一种制冷剂 |
10.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
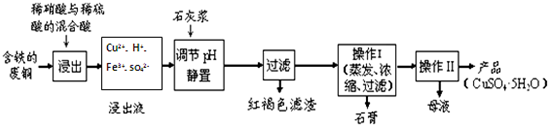
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.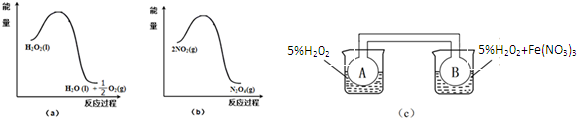
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.

8.上世纪50年代日本西部的婴儿大批发生贫血、腹泻、呕吐等症状,经调查都是食用“森永”牌奶粉所致,化验发现奶粉中含As量极高,As的来源是由于加入奶粉中的稳定剂Na2HPO4中含As严重超标.所以,切勿忽视添加剂的规格及级别,决不能随便代用.As在元素周期表中的位置是( )
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
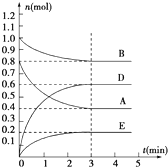 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示: