题目内容
16.某温度下反应H2(g)+I2(g)?2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1I2(g)及0.3mol•L-1HI(g),则下列说法中正确的是( )| A. | 反应正好达平衡 | |
| B. | 反应向左进行 | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应向某方向进行一段时间后c(H2)<0.2 mol•L-1 |
分析 根据题意,向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1I2(g)及0.3mol•L-1HI(g),Q=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$=$\frac{0.{3}^{2}}{0.2×0.5}$=9<K=57.0,据此分析.
解答 解:根据题意,向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1I2(g)及0.3mol•L-1HI(g),Q=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$=$\frac{0.{3}^{2}}{0.2×0.5}$=9<K=57.0;
A.反应向正反应方向进行,故A错误;
B.反应向右进行,故B错误;
C.温度不变,平衡常数不变,故C错误;
D.反应向正方向进行一段时间后,反应物浓度减小,c(H2)<0.2 mol•L-1,故D正确;
故选D.
点评 本题考查化学平衡的影响因素及计算、化学反应速率计算、化学平衡常数等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.氯气是有毒气体,曾被德国法西斯制成毒气弹用于侵略战争.当这种毒气顺风扩散时,通常可选用的防护办法是( )
①人躲到低洼的地方去;
②人躲到较高的地方去;
③多饮豆浆和牛奶;
④用沾有碳酸钠溶液的软布蒙面.
①人躲到低洼的地方去;
②人躲到较高的地方去;
③多饮豆浆和牛奶;
④用沾有碳酸钠溶液的软布蒙面.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
7.构成物质的聚集状态有固、液、气三种状态,科学研究表明,除了上述三种状态之外,还存在一些其它聚集状态,下列物质的状态属于其它聚集状态的是( )
①非晶体;②液晶;③纳米材料;④等离子体.
①非晶体;②液晶;③纳米材料;④等离子体.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
11.人类利用无机物合成的第一种有机物是( )
| A. | 电石气 | B. | 甲烷 | C. | 尿素 | D. | 醋酸 |
1.已知碳碳单键可以绕键轴旋转,关于结构简式可表示为的烃,下列说法中正确的是( )


| A. | 分子中至少有4个碳原子处于同一直线上 | |
| B. | 该烃苯环上的一氯代物有4种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
8.313K时,水的Kw=3.0×10-14,则在313K时,c(H+)=10-7 mol/L的溶液( )
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
5.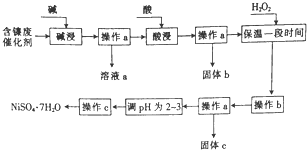 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a的名称是过滤.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
3.常见的离子晶体类型有多种,如图是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为( )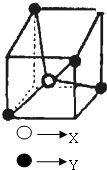

| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |