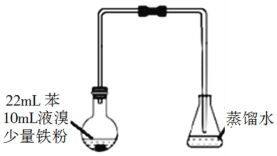
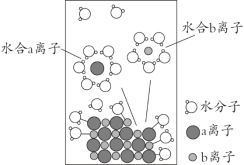
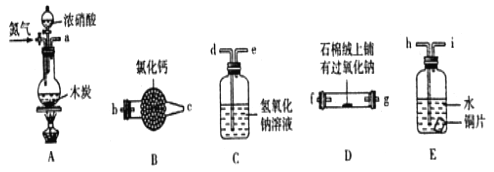
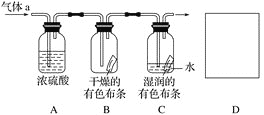
��Ŀ����
����Ŀ��������ѧ֪ʶ������������⣺
��1��AgNO3��ˮ��Һ��______�����������������������������ԣ�ԭ���ǣ������ӷ���ʽ��ʾ����_____��ʵ����������AgNO3����Һʱ������AgNO3���������ڽ�Ũ�������У�Ȼ����������ˮϡ�͵������Ũ�ȣ�Ŀ����______��
��2�����г�����������Һ��NH4Cl��Һ CH3COONa��Һ (NH4)2SO4��Һ NH4HSO4��Һ NaOH��Һ
��NH4Cl��Һ��pH_____7�����������������������������������¶ȿ���_______�������ٽ���������������NH4Cl��ˮ�⣻
��pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH_______NaOH��Һ��pH����������������������������
��Ũ����ͬ������������Һ����A��NH4Cl��Һ(B) (NH4)2SO4��Һ(C)NH4HSO4 ��Һ����c(NH4+)�ɴ�С��˳��Ϊ____��___��____���������գ���
��3������AlCl3��Һ���ܵõ���ˮAlCl3��ʹSOCl2��AlCl3��6H2O��ϲ����ȣ��ɵõ���ˮAlCl3���Խ���ԭ��________�� ����ʾ��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽΪSOCl2 +H2O= SO2��+ 2HCl����
���𰸡��� Ag�� �� H2O ![]() AgOH �� H�� ����Ag��ˮ�� �� �ٽ� �� B C A Al3+ +3H2O
AgOH �� H�� ����Ag��ˮ�� �� �ٽ� �� B C A Al3+ +3H2O ![]() Al(OH)3+3H+��AlCl3��6 H2O��SOCl2��ϼ��ȣ� SOCl2��AlCl3��6 H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ��
Al(OH)3+3H+��AlCl3��6 H2O��SOCl2��ϼ��ȣ� SOCl2��AlCl3��6 H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ��
��������
(1)��������ǿ�������Σ�ˮ��Һ��������ˮ�������ԣ�������������Һ��������������������ˮ�⣻
(2)��ǿ������������Һ��ˮ�⣬��Һ�����ԣ������¶ȴٽ��ε�ˮ�⣻
����������Ϊǿ����Һ��������Ϊǿ�������Σ����Ⱥ�����������Һ��pH�������䣬�������Ƶ�ˮ��̶�������ҺpH����
��Ũ����ͬʱ������淋Ļ�ѧʽ�к�������笠����ӣ�����Һ�к���笠�����Ũ���������������������������笠����ӵ�ˮ��Ƚ�笠�����Ũ�ȴ�С��
(3)SOCl2��AlCl36H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬�������Ȼ�����ˮ�⡣
(1)��������ǿ�������Σ�ˮ��Һ��������ˮ�������ԣ���Ӧ�����ӷ���ʽΪ��Ag++H2OAgOH+H+��ʵ����������AgNO3����Һʱ������AgNO3���������ڽ�Ũ�������У�Ȼ����������ˮϡ�͵������Ũ�ȣ����м�������Ŀ��������������ˮ�⣬������Һ����ǣ�
(2)��NH4ClΪǿ�������Σ�笠���������Һ��ˮ�⣬��Һ�����ԣ���Һ��pH��7���ε�ˮ��Ϊ���ȷ�Ӧ�������¶ȴٽ�NH4Cl��ˮ�⣻
��pH��ȵ�NaOH��Һ��CH3COONa��Һ��������Ϊǿ�������Σ����������ˮ����Һ��ʾ���ԣ����Ⱥ��������ӵ�ˮ��̶���������ҺpH�������Էֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH��NaOH��Һ��pH��
��Ũ����ͬ������������Һ��(A)NH4Cl��Һ��(B)(NH4)2SO4��Һ��(C)NH4HSO4��Һ��B�Ļ�ѧʽ�к�������笠����ӣ�����Һ��c(NH4+)���NH4HSO4�������������������笠����ӵ�ˮ�⣬��C��Һ��笠�����Ũ�ȴ���A������������Һ��c(NH4+)�ɴ�С��˳��Ϊ��B��C��A��
(3)����HCl�ӷ�������AlCl3��Һ���ܵõ���ˮAlCl3����ʹSOCl2��AlCl36H2O��ϲ����ȣ�SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã��ɵõ���ˮAlCl3���ʴ�Ϊ��Al3++3H2OAl(OH)3+3H+��AlCl36H2O��SOCl2��ϼ��ȣ�SOCl2��AlCl36H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ�⡣

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�