题目内容
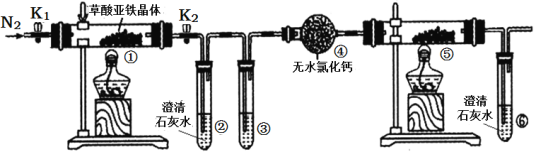
【题目】某化学课外活动小组通过实验探究NO能否与Na2O2反应以及反应后的产物,该小小组同学设计了如图所示装置(夹持仪器、连接用的乳胶管均已省略)。

经査阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式:________________。
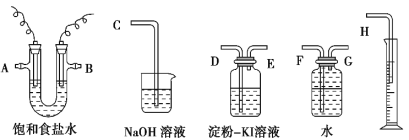
(2)为了完成实验,选择上图中的装置,其连接顺序为a→_______(按气流方向,用小写字母表示);有同学认为该装置存在缺陷,则该缺陷是______________。
(3)连接好仪器,_____________,装入药品后,要通入一段时间的氮气,在滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是_______________。
(4)装置E的作用是________________;能说明NO与Na2O2发生反应的实验现象是_____________。
(5)探充NO与Na2O2反应的产物。
假设1:产物只有NaNO3;假设2:_________________;
假设3:产物为NaNO3和NaNO2的混合物。
为验证反应产物,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为___________________,反应产物中NaNO2的质量分数为_____(保留四位有效数字)
【答案】 C +4HNO3(浓)![]() CO2↑+4NO2↑+2H2O h→i→d→e→b→c→f或g 缺少尾气处理装置 检验装置的气密性 排除装置中的空气,防止NO被空气中的O2氧化为NO2 制备NO D中固体由淡黄色变为白色 产物只有NaNO2 2MnO4 -+5NO2+6H+=5NO3- +2Mn2++3H2O 98.57%或0.99
CO2↑+4NO2↑+2H2O h→i→d→e→b→c→f或g 缺少尾气处理装置 检验装置的气密性 排除装置中的空气,防止NO被空气中的O2氧化为NO2 制备NO D中固体由淡黄色变为白色 产物只有NaNO2 2MnO4 -+5NO2+6H+=5NO3- +2Mn2++3H2O 98.57%或0.99
【解析】(1)木炭与浓硝酸反应生成CO2和NO2,反应的化学方程式为C +4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)实验过程中,利用木炭和浓硝酸反应生成的CO2、NO2混合气体通入E中,NO2可以和H2O反应生成HNO3和NO,金属Cu和稀HNO3反应生成NO,然后经过NaOH溶液,将其中的CO2吸收,此时剩余的气体是NO,用B中的氯化钙进行干燥,最后在D中检验NO和Na2O2是否反应,则根据气流方向,装置连接顺序为a→h→i→d→e→b→c→f或g;含有氮氧化物的尾气对环境有污染,应有尾气处理装置,这是装置的缺陷;
(3)装置连接好,要先检验装置气密性,再装药品进行实验;实验时先通一段时间的氮气,排除装置中的空气,防止NO被空气中的O2氧化为NO2,然后滴入浓硝酸,点燃酒精灯;
⑷装置E利用盛有的水与NO2反应制NO;若D中固体由淡黄色变为白色,即可说明NO与Na2O2发生了反应;
(5)按假设1、3逻辑关系,假设2为产物只有NaNO2;NaNO2中N元素为+3价,能被酸性KMnO4溶液氧化为NaNO3,离子反应为2MnO4-+5NO2-+6H+=5NO3-+2Mn2++3H2O,滴定过程中消耗KMnO4的物质的量是2×10-3mol,根据方程式可知参加反应的NaNO2的物质的量为5×10-3mol,质量为5×10-3mol×69g/mol=0.345g,被滴定的10mL溶液中含有0.35g反应后的固体,则反应产物中NaNO2的质量分数为0.345g÷0.35g×100%=98.57%。