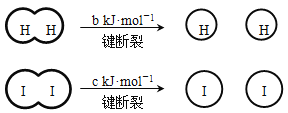
题目内容
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
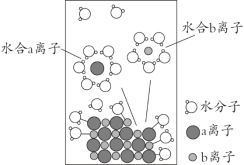
A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
【答案】C
【解析】
根据半径大小比较的方法,a离子为Cl-,b离子为Na+,然后溶解过程图示进行分析。
A、Na+核外有2个电子层,Cl-核外有3个电子层,即Cl-的半径大于Na+,a离子为Cl-,b为Na+,故A错误;
B、题目中没有说明溶液的体积,无法计算NaCl的物质的量,即无法判断Na+的数目,故B错误;
C、H2O中H+显+1价,b为Na+,根据同电相斥异电相吸的原理,Na+应被氧原子“包围”,即水合b离子的图示不科学,故C正确;
D、NaCl是强酸强碱盐,水溶液显中性,即pH=7,故D错误。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目