题目内容
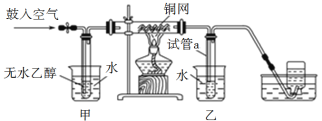
【题目】某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
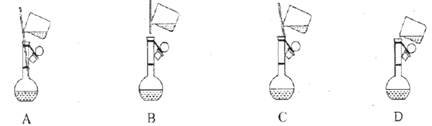
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
【答案】NO3-可能对验证Fe3+的氧化性有干扰 溶液由(棕)黄色变为浅绿色 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42 + 4H+ A Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+ FeCl3+ SO2 + H2O
Fe(OH)3 + 3H+ FeCl3+ SO2 + H2O ![]() [Fe(HSO3)]Cl2 + HCl 增大H+浓度,使“ FeCl3+ SO2 + H2O
[Fe(HSO3)]Cl2 + HCl 增大H+浓度,使“ FeCl3+ SO2 + H2O ![]() [Fe(HSO3)]Cl2 + HCl”平衡逆向移动,加快预期反应的速率
[Fe(HSO3)]Cl2 + HCl”平衡逆向移动,加快预期反应的速率
【解析】
本题考查SO2和FeCl3溶液反应的实验探究,涉及物质性质的分析,物质的量浓度溶液的配制,盐类的水解,外界条件对化学平衡的影响,结合相应知识进行分析;
I.(1)SO2溶于水显酸性,酸性条件下, NO3-也可将SO2氧化,干扰实验,因此,本题答案为:NO3-可能对验证Fe3+的氧化性有干扰;
(2)由于SO2具有还原性,Fe3+具有氧化性,预测SO2通入FeCl3溶液中SO2将Fe3+还原为Fe2+,可能观察到的现象是:溶液由棕黄色变为浅绿色。反应的离子方程式可表示为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,因此,本题答案为:溶液由(棕)黄色变为浅绿色 ;2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42 + 4H+ ;
II.(1)①“转移”时防止溶液外洒,应将玻璃棒的下端伸入容量瓶的刻度线以下,用玻璃棒引流溶液,故选A;
②FeCl3属于强酸弱碱盐,由于Fe3+的水解使溶液呈酸性,Fe3+水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+,因此,本题答案为:Fe3+ + 3H2O
Fe(OH)3+3H+,因此,本题答案为:Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+;
Fe(OH)3 + 3H+;
(2)根据资料,红棕色溶液中含[Fe(HSO3)]2+,该过程中元素的化合价没有变化,反应的化学方程式为SO2+FeCl3+H2O![]() [Fe(HSO3)]Cl2+2HCl,因此,本题答案为:FeCl3+ SO2 + H2O
[Fe(HSO3)]Cl2+2HCl,因此,本题答案为:FeCl3+ SO2 + H2O ![]() [Fe(HSO3)]Cl2 + HCl;
[Fe(HSO3)]Cl2 + HCl;
(3)出现红棕色是发生了反应SO2+FeCl3+H2O![]() [Fe(HSO3)]Cl2+2HCl,缩短红棕色时间,使上述平衡向逆反应方向移动。因此,本题答案为:增大H+浓度,使“ FeCl3+ SO2 + H2O
[Fe(HSO3)]Cl2+2HCl,缩短红棕色时间,使上述平衡向逆反应方向移动。因此,本题答案为:增大H+浓度,使“ FeCl3+ SO2 + H2O ![]() [Fe(HSO3)]Cl2 + HCl”平衡逆向移动,加快预期反应的速率;
[Fe(HSO3)]Cl2 + HCl”平衡逆向移动,加快预期反应的速率;

【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。