题目内容
14.在含有硝酸铜、硝酸镁、硝酸银的溶液中加入适量锌粉,首先置换出的是( )| A. | Mg | B. | Cu | C. | Ag | D. | H2 |
分析 已知活泼性顺序Mg>Zn>Cu>Ag,金属越活泼,对应的阳离子的氧化性越弱,加入锌粉,应首先置换出氧化性最强的离子.
解答 解:金属活泼性顺序Mg>Zn>Cu>Ag,则氧化性:Ag+>Cu2+>Zn2+>Mg2+,金属越活泼,对应的阳离子的氧化性越弱,则首先置换出Ag,
故选C.
点评 本题考查金属的活动性,题目难度不大,注意把握金属活动性顺序以及常见离子的氧化性强弱即可解答该题.

练习册系列答案
相关题目
4.近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是( )
| A. | 运液氯可用钢瓶装,车上应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志 标志 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 用铝锅煮菜一般在起锅之前才放盐,既减少加碘盐的损耗,又能增加铝锅的使用寿命 | |
| D. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 |
5.常温下,下列叙述正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
19.在下列各溶液中,粒子一定能大量共存的是( )
| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
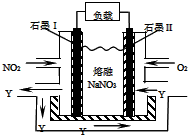 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
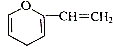
 、
、 、
、 ;
;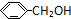 ;
;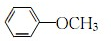 .
.