题目内容
8.已知A、B、C、D四种短周期元素原子序数依次增大,并依C、D、B、A顺序原子半径逐渐减小,且知A、C同主族,B、D同主族;B、D两原子核外电子数为A、C的原子核外电子数之和的两倍;C元素与其他三种元素均能形成离子化合物.试回答下列问题:(1)写出有关化学用语:①A的元素符号H;②B的原子结构示意图
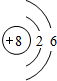 ;③C、D形成的化合物的电子式
;③C、D形成的化合物的电子式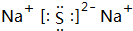 ;
;(2)同时含有上述四种元素的化合物有多种,试写出其中两种的化学式(要求:其中有一种水溶液呈中性)Na2HSO3,Na2SO4•10H2O;
(3)X、Y、Z、W四种常见化合物分别由上述四种元素中的三种组成,且各自组成元素均不完全相同,X、Y、W均为离子化合物,Z为共价化合物,且极易分解,在溶液中X、Y、Z两两之间均可反应,其中①Y与Z发生复分解反应可生成W;②X与过量Z发生氧化还原反应可生成D的单质,试写出上述反应的离子方程式.
①2OH-+H2SO3=SO32-+2H2O;
②2HS-+3H2SO3=3S↓+2HSO3-+3H2O.
分析 A、B、C、D四种短周期元素原子序数依次增大,C、D、B、A顺序原子半径逐渐减小,则A处于第一周期,B处于第二周期,C、D处于第三周期,且知A、C同主族,则A为H元素、C为Na;B、D两原子核外电子数为A、C的原子核外电子数之和的两倍,则B、D或者核外电子数为24,B、D同主族,则B为O元素、D为S元素.
(3)X、Y、Z、W四种常见化合物分别由上述四种元素中的三种组成,且各自组成元素均不完全相同,X、Y、W均为离子化合物,均含有Na元素,Z为共价化合物,由H、O、S三元素组成,且极易分解,在溶液中X、Y、Z两两之间均可反应,由②X与过量Z发生氧化还原反应可生成D的单质(硫),应是NaHS与H2SO3反应生成硫,可推知X为NaHS,Z为H2SO3,由①Y与Z发生复分解反应可生成W,则Y为NaOH,W为Na2SO3,据此解答.
解答 解:A、B、C、D四种短周期元素原子序数依次增大,C、D、B、A顺序原子半径逐渐减小,则A处于第一周期,B处于第二周期,C、D处于第三周期,且知A、C同主族,则A为H元素、C为Na;B、D两原子核外电子数为A、C的原子核外电子数之和的两倍,则B、D或者核外电子数为24,B、D同主族,则B为O元素、D为S元素.
(1)①A的元素符号为H;②B为O元素,原子结构示意图为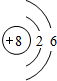 ;③C、D形成的化合物为Na2S,电子式为:
;③C、D形成的化合物为Na2S,电子式为: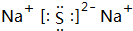 ,
,
故答案为:H;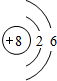 ;
;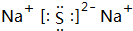 ;
;
(2)同时含有上述四种元素的化合物有Na2HSO3、NaHSO4、Na2SO4•10H2O等,Na2SO4•10H2O溶液呈中性,
故答案为:Na2HSO3、Na2SO4•10H2O;
(3)X、Y、Z、W四种常见化合物分别由上述四种元素中的三种组成,且各自组成元素均不完全相同,X、Y、W均为离子化合物,均含有Na元素,Z为共价化合物,由H、O、S三元素组成,且极易分解,在溶液中X、Y、Z两两之间均可反应,由②X与过量Z发生氧化还原反应可生成D的单质(硫),应是NaHS与H2SO3反应生成硫,可推知X为NaHS,Z为H2SO3,由①Y与Z发生复分解反应可生成W,则Y为NaOH,W为Na2SO3,
①的反应离子方程式为:2OH-+H2SO3=SO32-+2H2O,
②的反应离子方程式为:2HS-+3H2SO3=3S↓+2HSO3-+3H2O,
故答案为:2OH-+H2SO3=SO32-+2H2O;2HS-+3H2SO3=3S↓+2HSO3-+3H2O.
点评 本题考查结构性质位置关系应用、无机物推断、常用化学用语等,(3)中②为易错点,反应过程可以理解为:过量的亚硫酸与硫氢化钠反应得到硫化氢与亚硫酸氢钠,硫化氢再与亚硫酸反应得到硫.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
| A. | Cl-的结构示意图: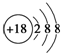 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧化钠的电子式: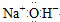 | D. | 铁元素不属于主族元素 |
| A. | HCl | B. | Na2O2 | C. | H2O | D. | CaCl2 |
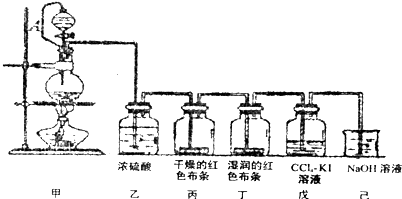
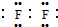 ;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.
;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.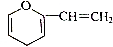
 、
、 、
、 ;
;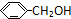 ;
; .
.