题目内容
18.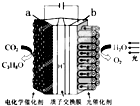 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
分析 A、与电源正极相连的是阳极,发生氧化反应;
B、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
C、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动;
D、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O.
解答 解:A、b与电源正极相连,所以b是阳极,发生氧化反应,故A错误;
B、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故B错误;
C、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故C错误;
D、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故D正确;
故选D.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.

练习册系列答案
相关题目
8.下列反应必须加入氧化剂才能实现的是( )
| A. | CH4→CO2 | B. | KMnO4→K2MnO4 | C. | SO2→SO32- | D. | H2O2→O2 |
6.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
13.室温下由水电离出的H+的浓度是1×10-12mol/L,则该溶液( )
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
3.某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如表实验:
(1)实验1中能发生反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图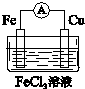 .
.
②该电池的正极反应为2Fe3++2e-=2Fe2+.
| 实验1 | 常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 | 再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图
 .
.②该电池的正极反应为2Fe3++2e-=2Fe2+.
10.下列各项叙述中,正确的是( )
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
7.下列叙述正确的是( )
| A. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| B. | 将氢氧化钠稀溶液逐滴滴入氯化铁饱和溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| C. | 由于氢氧化铁胶体带正电,所以电泳时阴极颜色加深 | |
| D. | 浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液 |

 .
.