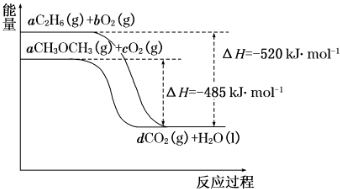
题目内容
8.下列反应必须加入氧化剂才能实现的是( )| A. | CH4→CO2 | B. | KMnO4→K2MnO4 | C. | SO2→SO32- | D. | H2O2→O2 |
分析 必须加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A、CH4→CO2中C元素的夹套升高,必须加入氧化剂才能实现,故A正确;
B、该反应中Mn元素化合价由+7价变为+6价,高锰酸钾作氧化剂,但不需要加入还原剂也能实现,如加热高锰酸钾制取氧气,故B错误;
C、SO2→SO32-中S元素的价态没有发生改变,故不需加入氧化剂或还原剂,故C错误;
D、H2O2→O2中O元素的价态升高,但不需要加入氧化剂,双氧水自身分解即可产生氧气,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,明确元素化合价变化与氧化剂、还原剂关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
16.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
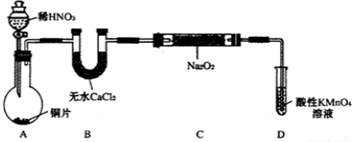
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与④号色阶相同.则甲同学制得的样品中NaN02的质量分数是:60%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):

(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡, 再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
20.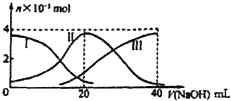 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
18.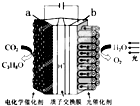 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
19.下列说法正确的是( )
| A. | 摩尔是国际单位制中的7 个基本物理量之一 | |
| B. | 硫酸的摩尔质量是98 g | |
| C. | 0.5molH2 约含有3.01×1023个氢原子 | |
| D. | NA个氧气分子与NA 个氢气分子的质量比为16:1 |