题目内容
6.下列热化学方程式或离子方程式中,正确的是( )| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,水液态时更稳定;
B.氮气与氢气合成氨气为可逆反应,不能进行到底;
C.二者反应生成氢氧化镁沉淀和氯化铵;
D.不符合反应客观事实.
解答 解:A.则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,故A错误;
B.0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C.氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C正确;
D.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式:Al2O3+2OH-=2AlO2-+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意可逆反应热化学方程式中反应热的含义,题目难度不大.

练习册系列答案
相关题目
8.写出下列物质溶于水时的电离方程式:
①Fe2(SO4)3Fe2(SO4)3═2Fe3++3SO42-;②NaHSO4NaHSO4═Na++H++SO42-;③KMnO4KMnO4═K++MnO4-.
①Fe2(SO4)3Fe2(SO4)3═2Fe3++3SO42-;②NaHSO4NaHSO4═Na++H++SO42-;③KMnO4KMnO4═K++MnO4-.
16.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
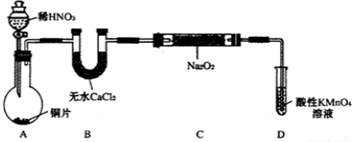
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与④号色阶相同.则甲同学制得的样品中NaN02的质量分数是:60%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):

(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡, 再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
20.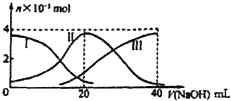 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
11.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是( )
| A. | 分别与足量CaCO3反应时,放出的CO2一样多 | |
| B. | 与NaOH完全中和时,醋酸所消耗的NaOH多 | |
| C. | 两种溶液的pH相等 | |
| D. | 取等体积盐酸和CH3COOH溶液,分别加水稀释a倍和b倍,溶液的pH相等,则a<b |
18.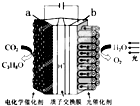 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
16.X、Y、Z是3种短周期元素,X原子最外层电子排布为3s1;Y原子的M层中有两个未成对电子;Z原子的L层的p轨道中有4个电子.则下列比较中正确的是( )
| A. | 电负性:Y>Z>X | B. | 原子半径:X>Z>Y | ||
| C. | 最高化合价:Z>X>Y | D. | 第一电离能:Z>Y>X |