题目内容
13.室温下由水电离出的H+的浓度是1×10-12mol/L,则该溶液( )| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
分析 在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制了水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断.
解答 解:在25℃时,溶液中由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,故选D.
点评 本题考查了水的电离及影响水的电离的因素,题目难度中等,注意明确溶液中的溶质是抑制水电离是解本题的关键,能电离出氢离子或氢氧根离子的物质抑制水电离,试题培养了学生的分析、理解能力及灵活应用所学知识能力.

练习册系列答案
相关题目
20.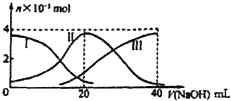 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
18.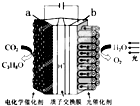 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
3.下列各组性质的比较中,不正确的是( )
| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:HCl>HBr | ||
| C. | 失电子能力:K>Na | D. | 原子半径:CI>S |

 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.