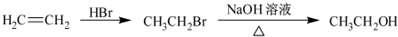题目内容
15.第四周期中的18种元素具有重要的用途.(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为分子晶体,中心原子的杂化类型为sp3.
(2)第四周期ⅤA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)Br>Se>As.
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子CN-、C22-;配体NH3分子的空间构型为三角锥形.
(4)金属钒在材料科学上有重要作用,被称为”合金的维生素”,基态钒原子的价电子排布式为3d34s2,第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原因是Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga.
分析 (1)四溴化锗的熔沸点低,所以GeBr4是分子晶体;锗与溴形成四个共价键,所以中心原子的杂化类型为sp3;
(2)同周期主族元素电负性从左到右渐增;
(3)CO的电子数为14,含有2个原子,根据等电子体的定义分析;根据NH3中N原子为杂化sp3,有一对弧对电子对,所以分子的空间构型为三角锥形;
(4)钒元素的基态原子的简化电子排布式式[Ar]3d34s2,其价电子是排布式为3d34s2,根据价电子排布判断电离能的大小.
解答 解:(1)四溴化锗的熔沸点低,所以GeBr4是分子晶体;锗与溴形成四个共价键,所以中心原子的杂化类型为sp3,故答案为:分子晶体;sp3;
(2)同周期主族元素电负性从左到右渐增,所以第四周期电负性由大到小的顺序:Br>Se>As,故答案为:Br>Se>As;
(3)CO的电子数为14,含有2个原子,它的等电子体有等CN-、C22-,NH3中N原子为杂化sp3,有一对弧对电子对,所以分子的空间构型为三角锥形,故答案为:CN-、C22-;三角锥形;
(4)钒元素的基态原子的简化电子排布式式[Ar]3d34s2,其价电子是排布式为3d34s2,Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:3d34s2;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga.
点评 本题考查较为综合,晶体类型的判断、价电子是排布、电负性和电离能等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.固体粉末M中可能含有Cu、FeO、Fe2O3、K2SO3、Na2CO3、KCl中的若干种.为确定该固体粉末的成分,现取M进行下列实验,实验过程及现象如下:下列有关说法正确的是( )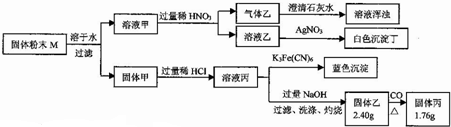

| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
6.短周期元素A、B、C、D的原子序数依次增大,它们原子的最外层电子数之和为16,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是( )
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
10. 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②H2O(l)=H2O(g)△H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为K=$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$.
②下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小的是(双选)CD.
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)<
(填“<”或“>”或“=”) 20.00mL.
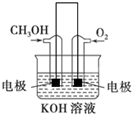
(4)利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(5)合成甲醇的主要反应为:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验.实验数据见下表:
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率越高.
结论二:原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低.
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②H2O(l)=H2O(g)△H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为K=$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$.
②下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小的是(双选)CD.
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)<
(填“<”或“>”或“=”) 20.00mL.
(4)利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(5)合成甲醇的主要反应为:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验.实验数据见下表:
| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳转化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率越高.
结论二:原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低.
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
10.化学源于生活又服务于生活,下列说法正确的是( )
| A. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生盐析 |
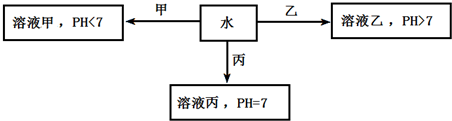
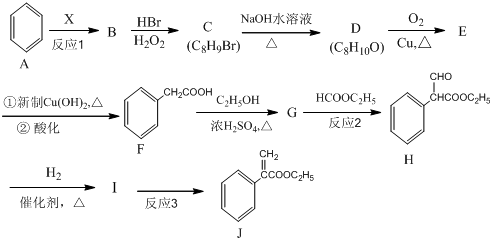
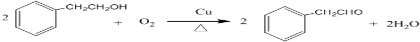 ;
;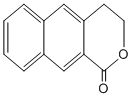 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,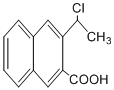 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: