题目内容
【题目】治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
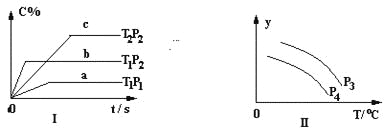
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
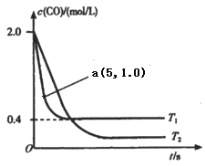
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
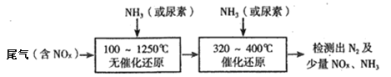
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
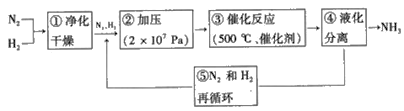
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)
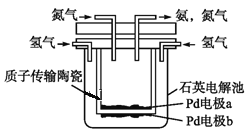
A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
【答案】放热 80 160:1 4NH3+4NO+O2(g)=4N2+6H2O ②④⑤ BCD CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-978.0 kJ/mol
【解析】
(1)①从图中可以看出,T1时反应先达平衡,则T1>T2,T1时c(CO)大,说明升高温度,平衡逆向移动。
② 依题意,可得如下三段式:

温度T1时,该反应的平衡常数K=![]() ,反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,平衡时,k正c2(NO)c2(CO)=k逆c2(CO2)c(N2),即k正×0.42×0.42=k逆×0.8×1.62,k正=80 k逆。
,反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,平衡时,k正c2(NO)c2(CO)=k逆c2(CO2)c(N2),即k正×0.42×0.42=k逆×0.8×1.62,k正=80 k逆。

计算a处v(正):v(逆)= k正c2(NO)c2(CO:k逆c2(CO2)c(N2)= 80 k逆×1.02×1.02: k逆×0.5×1.02=160:1
(2)用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1),NO得2e-,NH3失去3e-,得失电子总数不等,则另有得电子的物质,只能为空气中的O2,由此可得出反应的化学方程式。
(3)五个流程中为提高原料利用率而采取的措施:加压,有利于平衡正向移动,提高反应物的转化率;加催化剂只能加快反应速率,但不能使平衡发生移动;液化分离NH3,虽然不能加快反应速率,但能使平衡正向移动;N2和H2循环使用,也可提高反应物的转化率。
(4)从图中可以看出,H2失电子,Pd电极b为阳极,则Pd电极a为阴极。
A.Pd电极b为阳极,A错误;
B.阴极N2得电子,生成NH3,电极反应式为N2+6H++6e-=2NH3,B正确;
C.阳极生成H+,通过质子传输陶瓷向阴极迁移,C正确;
D.陶瓷只允许H+通过,可以隔离N2和H2,D正确。
(5) ①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则①+②-③×2可得CH4催化还原NO的热化学方程式。
(1)①从图中可以看出,T1时反应先达平衡,则T1>T2,T1时c(CO)大,说明升高温度,平衡逆向移动,从而得出正反应为放热反应。答案为:放热;
② 依题意,可得如下三段式:

温度T1时,该反应的平衡常数K=![]() =80,反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,平衡时,k正c2(NO)c2(CO)=k逆c2(CO2)c(N2),即k正×0.42×0.42=k逆×0.8×1.62,k正=80 k逆。
=80,反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,平衡时,k正c2(NO)c2(CO)=k逆c2(CO2)c(N2),即k正×0.42×0.42=k逆×0.8×1.62,k正=80 k逆。

计算a处v(正)v(逆)= k正c2(NO)c2(CO:k逆c2(CO2)c(N2)= 80 k逆×1.02×1.02: k逆×0.5×1.02=160:1。答案为:80;160:1;
(2)用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1),NO得2e-,NH3失去3e-,得失电子总数不等,则另有得电子的物质,只能为空气中的O2,由此可得出反应的化学方程式4NH3+4NO+O2(g)=4N2+6H2O。答案为:4NH3+4NO+O2(g)=4N2+6H2O;
(3)五个流程中为提高原料利用率而采取的措施:加压,有利于平衡正向移动,提高反应物的转化率;加催化剂只能加快反应速率,但不能使平衡发生移动;液化分离NH3,虽然不能加快反应速率,但能使平衡正向移动;N2和H2循环使用,也可提高反应物的转化率。答案为:②④⑤;
(4)从图中可以看出,H2失电子,Pd电极b为阳极,则Pd电极a为阴极。
A.Pd电极b为阳极,A错误;
B.阴极N2得电子,生成NH3,电极反应式为N2+6H++6e-=2NH3,B正确;
C.阳极生成H+,通过质子传输陶瓷向阴极迁移,C正确;
D.陶瓷只允许H+通过,可以隔离N2和H2,D正确。答案为:BCD;
(5) ①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则①+②-③×2可得CH4催化还原NO的热化学方程式为CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-978.0 kJ/mol。答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-978.0 kJ/mol。

【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
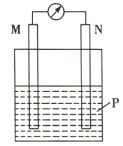
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D