题目内容
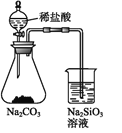
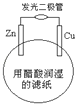
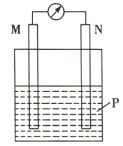
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
【答案】C
【解析】
经分析可知该装置是原电池,其中M棒作正极,有金属单质析出,N棒作负极,失电子溶解。
A.电解质溶液分别为稀硫酸,原电池工作时,不会有金属析出,A错误;
B.综上分析,其中M棒作正极,有金属单质析出,N棒作负极,失电子溶解,电解质溶液分别为稀硫酸,原电池工作时,不会有金属析出,B错误;
C.正极的电极反应为![]() ,负极的电极反应为
,负极的电极反应为![]() ,符合题意,C正确;
,符合题意,C正确;
D.正极的电极反应为![]() ,不会有金属析出,D错误;
,不会有金属析出,D错误;
答案选C。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D