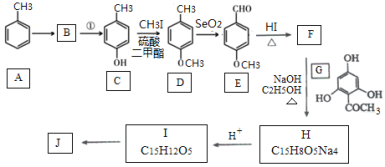
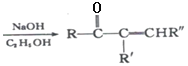
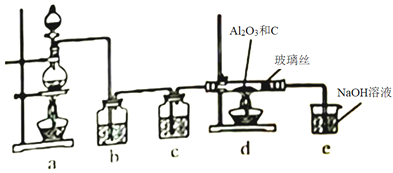
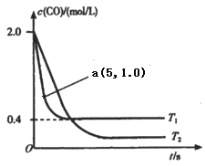
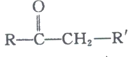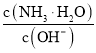题目内容
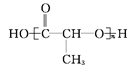
【题目】铜的化合物如Cu2O、CuO、CuCl、CuSO4·5H2O、Cu(IO3)2、[Cu(H2NCH2CH2NH2)2]Cl2等均有着广泛的应用.回答下列问题:
(1)基态Cu2+的核外电子排布式为____________
(2)IO3-的空间构型为_____________________________(用文字描述),与SO42-互为等电子体的分子为____________
(3)配离子[Cu(H2NCH2CH2NH2)2]2+中,Cu2+的配位数是____________.
①乙二胺分子中N 原子轨道的杂化类型为____________.
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中含有的σ键的数目为____________.
(4)CuO的熔点比CuCl的熔点高,其原因是____________.
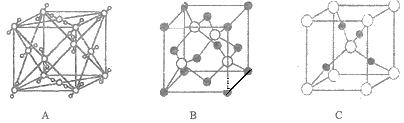
(5)Cu2O晶体结构可能是____________ (填字母).
【答案】1s22s22p6 3s23p63d9或[Ar]3d9 三角锥形 SiF4、CCl4等 4 sp3杂化 26 NA CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大 C
【解析】
(1)基态Cu2+的核外电子排布式为1s22s22p6 3s23p63d9或[Ar]3d9。
(2)IO3-中I与3个O原子形成共价键后,I的最外层还有一对孤对电子,对形成的三个共价键有排斥作用,从而使结构不对称;寻找与SO42-互为等电子体的分子时,可将O换成F或Cl,然后再通过价电子数相等,将S替换为C或Si。
(3) 配离子[Cu(H2NCH2CH2NH2)2]2+中,1个H2NCH2CH2NH2与Cu2+形成2个配位键,从而得出配位键的数目。
①乙二胺分子中N 原子,除去含有一对孤对电子外,还形成了3个共价键。
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中,1个H2NCH2CH2NH2含有11个共价单键,2个H2NCH2CH2NH2含有22个共价单键,另外,Cu2+与N还形成了4个配位键,从而得出含有的σ键的数目。
(4)CuO的熔点比CuCl的熔点高的原因,从离子所带电荷、离子半径寻找答案。
(5)从离子个数比为2:1,分析三个晶体结构,从而确定Cu2O晶体结构。
A中,顶点含8个分子,面心含6个分子,晶体共含4个分子;B中,顶点含8个黑球,面心含6个黑球,晶体内含有4个白球,该晶体中共含4个黑球,4个白球;C中,顶点含8个白球,体心含1个白球,晶体内含4个黑球,该晶体中共含有2个白球,4个黑球。
(1)基态Cu2+的核外电子排布式为1s22s22p6 3s23p63d9或[Ar]3d9。答案为:1s22s22p6 3s23p63d9或[Ar]3d9;
(2)IO3-中I与3个O原子形成共价键后,I的最外层还有一对孤对电子,对形成的三个共价键有排斥作用,从而使结构不对称,所以结构为三角锥形;寻找与SO42-互为等电子体的分子时,可将O换成F或Cl,然后再通过价电子数相等,将S替换为C或Si,从而得出分子为SiF4、CCl4等。答案为:三角锥形;SiF4、CCl4等;
(3) 配离子[Cu(H2NCH2CH2NH2)2]2+中,1个H2NCH2CH2NH2与Cu2+形成2个配位键,从而得出配位键的数目为4。答案为:4;
①乙二胺分子中N 原子,除去含有一对孤对电子外,还形成了3个共价键,从而得出N原子轨道的杂化类型为sp3杂化。答案为:sp3杂化;
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中,1个H2NCH2CH2NH2含有11个共价单键,2个H2NCH2CH2NH2含有22个共价单键,另外,Cu2+与N还形成了4个配位键,由此得出1个[Cu(H2NCH2CH2NH2)2]2+含有的σ键的数目为26个,从而得出1mol [Cu(H2NCH2CH2NH2)2]2+中,含26 NA个σ键。答案为:26 NA;
(4)CuO的熔点比CuCl的熔点高,原因是CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大。答案为:CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大;
(5)从离子个数比为2:1,分析三个晶体结构,从而确定Cu2O晶体结构为C(黑球与白球的个数比为2:1)。答案为:C。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
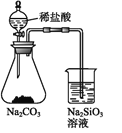
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D