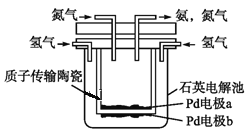
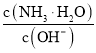题目内容
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)![]() E(g),当反应进行到4min时达到平衡,测得M的浓度为0.2mol·L-1。下列说法正确的是( )
E(g),当反应进行到4min时达到平衡,测得M的浓度为0.2mol·L-1。下列说法正确的是( )
A.2min时,M的物质的量浓度为0.6mol·L-1
B.0~4min内,v(M)=0.8mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.4min时,M的转化率为80%
【答案】D
【解析】
A.反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4molL-1,所以2min时,M的物质的量浓度应小于0.6molL-1,故A错误;
B.4min时,用M表示的反应速率为:![]() =0.2molL-1min-1,故B错误;
=0.2molL-1min-1,故B错误;
C.恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变,故C错误;
D.反应开始时,M的浓度为:![]() =1mol/L,平衡时为0.2molL-1,转化了0.8molL-1,M转化率为80%,故D正确;
=1mol/L,平衡时为0.2molL-1,转化了0.8molL-1,M转化率为80%,故D正确;
故答案为D。

练习册系列答案
相关题目
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
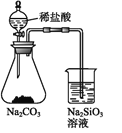
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D