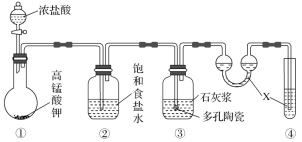
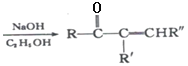
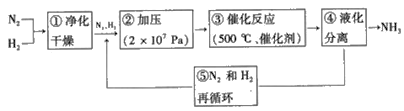
题目内容
【题目】下列指定反应的离子方程式正确的是
A.向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O
B.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O
D.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42—沉淀完全:Al3++2SO42—+2Ba2++4OH—=AlO2-+2BaSO4↓+2H2O
【答案】D
【解析】
A.过量的CO2与NaOH溶液反应生成碳酸氢钠,离子方程式为CO2+OH-=HCO3-,A项错误;
B.氢氧化镁是沉淀,所以电解氯化镁溶液的离子方程式为Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,B项错误;
Cl2↑+H2↑+Mg(OH)2↓,B项错误;
C.电荷不守恒,离子方程式为H2O2+2H++MnO2=O2↑+Mn2++2H2O,C项错误;
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42—沉淀完全,假定KAl(SO4)2的物质的量1mol,SO42—沉淀完全符合离需要2mol Ba(OH)2,离子方程式符合物质比例,以及书写原则,D项正确;
答案选D。

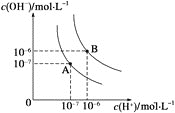
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。