题目内容
17.下列解释实验事实的方程式中,不准确的是( )| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3═Na++H++SO32- | |
| D. | 在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
分析 A.醋酸根离子在溶液中部分水解,溶液显示碱性;
B.氢氧化铁比氢氧化镁更难溶,实现了沉淀的转化;
C.亚硫酸氢钠溶液中,亚硫酸氢根离子的电离程度大于其水解程度,应该写亚硫酸氢根离子的电离方程式;
D.酸性高锰酸根离子将双氧水氧化成氧气.
解答 解:A.在CH3COONa溶液中,醋酸根离子部分水解,导致溶液显示碱性,所以滴入无色酚酞溶液变红,水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,故A正确;
B.在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,氢氧化镁沉淀 转化成氢氧化铁沉淀,所以悬浊液变红褐色,反应的离子方程式为:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+,故B正确;
C.亚硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性,正确的电离离子方程式为:HSO3-?H++SO32-,故C错误;
D.稀H2SO4酸化的KMnO4溶液中滴入双氧水,发生了氧化还原反应,所以溶液褪色,反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故D正确;
故选C.
点评 本题考查了离子方程式判断,题目难度中等,试题涉及盐的水解原理、弱电解质的电离等知识,为高考的高频题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
7.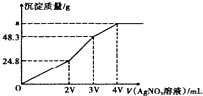 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
8.化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
(1)若A的水溶液为酸性,往B的水溶液加Al有气体产生,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀,①B的化学式为Ba(OH)2;
②A、B溶液混合后加热能产生气体的反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A为FeI2;
②经分析上述过程中溶液变黄的原因可能有两种:
I仅有I-被氧化成I2使溶液呈黄色ⅡI-、Fe2+均被氧化使溶液呈黄色;
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
②A、B溶液混合后加热能产生气体的反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A为FeI2;
②经分析上述过程中溶液变黄的原因可能有两种:
I仅有I-被氧化成I2使溶液呈黄色ⅡI-、Fe2+均被氧化使溶液呈黄色;
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
5.下列物质递变规律不能用元素周期律解释的是( )
| A. | 非金属性:C>Si | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 还原性:HI>HBr |
12.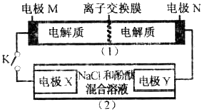 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
装置(2)为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
 如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.
如图装置(1)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3$?_{放电}^{充电}$K2S4+3KI.装置(2)为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
| A. | K+从右到左通过离子交换膜 | |
| B. | 电极M的反应式:I3-+2e-=3I- | |
| C. | 电极X的反应式:4OH--4e-═O2↑+2H2O | |
| D. | 当电极Y有0.2mole-转移时,产生0.1molCl2 |
2. 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )| A. | 分子式为C14H18N2O3,属于蛋白质 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
9.如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )


| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | M、N、R、W的简单离子均能促进水的电离 | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
6.下列指定反应的离子方程式正确的是( )
| A. | Na2O与水反应:O2-+H2O═2OH- | |
| B. | SO2使氯水褪色:SO2+Cl2+2H2O═4H++SO42-+2Cl- | |
| C. | Na2SiO3溶液与盐酸反应:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+2H2O |