题目内容
8.化合物A、B是中学常见的物质,其阴阳离子可从下表中选择| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
②A、B溶液混合后加热能产生气体的反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A为FeI2;
②经分析上述过程中溶液变黄的原因可能有两种:
I仅有I-被氧化成I2使溶液呈黄色ⅡI-、Fe2+均被氧化使溶液呈黄色;
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
分析 (1)A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀,由给出的离子可知,白色沉淀为BaSO4,A的水溶液为酸性,往B的水溶液加Al有气体产生,可推知A中含有HSO4-,B中含有Ba2+、OH-,则B为Ba(OH)2;A、B溶液混合后加热能产生气体,则A为NH4HSO4;
(2)若A的水溶液为浅绿色,含有Fe2+,B的焰色反应呈黄色,含有Na+,向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,说明在酸性条件下发生了氧化还原反应,则B的溶液一定含有NO3-离子,B为NaNO3,A、B的水溶液混合后无明显变化,结合离子共存,可推知A含有I-,故A为FeI2.
解答 解:(1)A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀,由给出的离子可知,白色沉淀为BaSO4,A的水溶液为酸性,往B的水溶液加Al有气体产生,可推知A中含有HSO4-,B中含有Ba2+、OH-,则B为Ba(OH)2;A、B溶液混合后加热能产生气体,则A为NH4HSO4;
①B的化学式为:Ba(OH)2;
②A、B溶液混合后加热能产生气体的反应的离子方程式为:H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O,
故答案为:Ba(OH)2;H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O;
(2)①若A的水溶液为浅绿色,含有Fe2+,B的焰色反应呈黄色,含有Na+,向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,说明在酸性条件下发生了氧化还原反应,则B的溶液一定含有NO3-离子,B为NaNO3,A、B的水溶液混合后无明显变化,结合离子共存,可推知A含有I-,故A为FeI2,
故答案为:FeI2;
②A溶液中的Fe2+和I-都具有还原性,且I-还原性强于Fe2+离子,若硝酸根离子不足,溶液变黄的原因碘离子被氧化成碘单质使溶液呈黄色;若硝酸根离子足量,氧化完碘离子后还有剩余,能够继续氧化亚铁离子,所以溶液呈黄色I-、Fe2+均被氧化,
故答案为:仅有I-被氧化成I2使溶液呈黄色;I-、Fe2+均被氧化使溶液呈黄色;
③若反应后的溶液中存在铁离子,证明Ⅱ合理,操作方法为:取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理,
故答案为:取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理,否则Ⅰ合理.
点评 本题考查常见离子的检验、未知物的推断、实验方案设计等知识,题目难度中等,根据特殊反应及形象,结合离子共存判断,充分考查学生对元素化合物知识掌握.

| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
| A. | 0.1 mol ${\;}_{8}^{16}$OD- 离子含有的质子、中子数均为1.0NA | |
| B. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| C. | 3.6 g石墨中,含有共价键数为0.3NA | |
| D. | 标准状况下,4.48 L己烷含有的分子数为0.2NA |
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 |  |
| B | 步骤2:将海带灰溶解、过滤 | 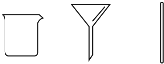 |
| C | 步骤3:氧化滤液中的I- |  |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3═Na++H++SO32- | |
| D. | 在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷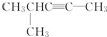 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔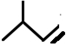
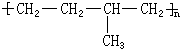 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别