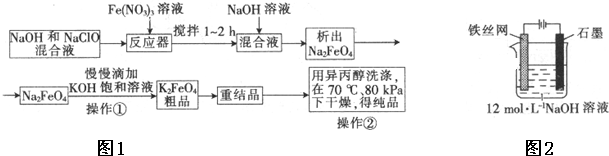
题目内容
6.下列指定反应的离子方程式正确的是( )| A. | Na2O与水反应:O2-+H2O═2OH- | |
| B. | SO2使氯水褪色:SO2+Cl2+2H2O═4H++SO42-+2Cl- | |
| C. | Na2SiO3溶液与盐酸反应:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+2H2O |
分析 A.氧化钠为氧化物,离子方程式中不能拆开;
B.二氧化硫与氯气发生氧化还原反应生成硫酸和盐酸;
C.硅酸钠为易溶的强电解质,离子方程式中需要拆开;
D.氢氧化钠过量,离子方程式按照碳酸氢钙的化学式组成书写.
解答 解:A.Na2O与水反应生成氢氧化钠,正确的离子方程式为:Na2O+H2O═2Na++2OH-,故A错误;
B.二氧化硫具有还原性,氯气具有强氧化性,所以SO2能够使氯水褪色,反应的离子方程式为:SO2+Cl2+2H2O═4H++SO42-+2Cl-,故B正确;
C.Na2SiO3溶液与盐酸反应,硅酸钠需要拆开,正确的离子方程式为:SiO32-+2H+═H2SiO3↓,故C错误;
D.氢氧化钠过量,碳酸氢钙与氢氧化钠溶液反应生成碳酸钙、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,注意反应物过量情况对生成物的影响.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
17.下列解释实验事实的方程式中,不准确的是( )
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3═Na++H++SO32- | |
| D. | 在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
14. 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |
1.下列有关化学用语表示正确的是( )
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
15.下列化学用语表示正确的是( )
| A. | KF的电子式: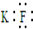 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
 X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.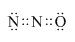 .
. 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔
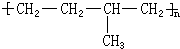 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别