题目内容
9.如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )
| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | M、N、R、W的简单离子均能促进水的电离 | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
分析 由部分短周期元素原子序数与最外层电子数之间的关系图,可知X为N元素、Y为O元素,Z为Na,M为Mg,N为Al,R为S,W为Cl.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.常温水为液态,其它气态为气体,故水的沸点最高,再结合氢键、相对分子质量对分子间作用力影响分析氨气、HCl、硫化氢的沸点高低;
C.氯离子不能促进水的电离;
D.Al能与强酸、强碱反应.
解答 解:由部分短周期元素原子序数与最外层电子数之间的关系图,可知X为N元素、Y为O元素,Z为Na,M为Mg,N为Al,R为S,W为Cl.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(Na+)>r(Mg2+),故A错误;
B.常温水为液态,其氨气、HCl、硫化氢气态为气体,故水的沸点最高,氨气分子之间存在氢键,沸点高于硫化氢、HCl,而HCl相对分子质量较大,分子间作用力较强,沸点高于硫化氢,故沸点:水>氨气>氯化氢>硫化氢,故B错误;
C.Mg2+、Al3+、S2-在溶液中均发生水解,促进水的电离,而Cl-不发生水解,不能促进水的电离,故C错误;
D.Z、X、R、W的最高价氧化物对应的水化物分别为NaOH、硝酸、硫酸、高氯酸,均能与Al发生反应,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,关键是熟练掌握1-18号元素,B选项中注意熔沸点比较规律,D选项中学生容易受Al在浓硝酸中钝化影响,为易错点.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
19.下列说法正确的是( )
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
20.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到( )
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 |  |
| B | 步骤2:将海带灰溶解、过滤 |  |
| C | 步骤3:氧化滤液中的I- |  |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
17.下列解释实验事实的方程式中,不准确的是( )
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3═Na++H++SO32- | |
| D. | 在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
4.已知下表数据:
对于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | |
| D. | 向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
14.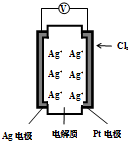 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |
1.下列有关化学用语表示正确的是( )
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
19.某温度下,在2L密闭容器中充入一定量的N2O5,发生反应:2N2O5?4NO2+O2.反应开始时,c(N2O5)=0.04mol•L-1,30s后,c(O2)=0.01mol•L-1,则N2O5的平均反应速率为( )
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷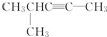 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔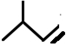
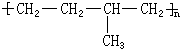 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别