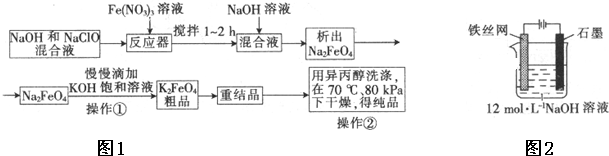
题目内容
7.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.(1)常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)称取6.0g含H2C2O4•2H2O、KHC2O4和K2SO4的试样,加水溶解配成250mL溶液,量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25mol•L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液滴加0.10mol•L-1酸性KMnO4溶液至16mL时反应完全.则原试样中H2C2O4•2H2O的质量分数为21%.
分析 (1)草酸和氢氧化钠的物质的量相等,二者恰好反应生成草酸氢钠,根据草酸氢铵溶液显示酸性及电荷守恒判断溶液中各离子浓度大小;
(2)根据n=cV计算出氢氧化钠、高锰酸钾的物质的量,利用反应关系式确定H2C2O4•2H2O、KHC2O4的总物质的量,再根据消耗氢氧化钠的物质的量列式计算出25mL样品溶液中含有的H2C2O4•2H2O、KHC2O4的物质的量,然后计算出250mL样品溶液中含有的H2C2O4•2H2O的物质的量,最后计算出其质量分数.
解答 解:(1)向10mL 0.01mol•L-1的H2C2O4溶液滴加10mL 0.01mol•L-1NaOH溶液,草酸与氢氧化钠恰好反应生成草酸氢钠,由于草酸氢钠溶液显示酸性,则HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为:$\frac{0.0016×5}{2}$mol=4×10-3mol,
20mL 0.25mol/L的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.25mol/L×0.02L=5×10-3mol,
设原样品中含有H2C2O4•2H2O的物质的量为x,含有KHC2O4的物质的量为y,则:2x+y=5×10-3mol、x+y=4×10-3mol,
解得:x=10-3mol、y=3×10-3mol,
原样品中含有H2C2O4•2H2O物质的量为:10-3mol×$\frac{250mL}{25mL}$=0.01mol,
所以原试样中H2C2O4•2H2O的质量分数为:$\frac{126g/mol×0.01mol}{6.0g}$×100%=21%,
故答案为:21%.
点评 本题考查了离子浓度大小比较、中和滴定的计算,题目难度中等,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用,明确关系式法在化学计算中的应用.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+═2Fe(OH)3↓+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3═Na++H++SO32- | |
| D. | 在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
| A. | KF的电子式: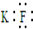 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸:AlO2-、CO32-、HCO3-、OH- |
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为2Cl--2e-=Cl2↑;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在阳(填“阴”或“阳”)极生成高铁酸钾(K2FeO4).
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如图1:
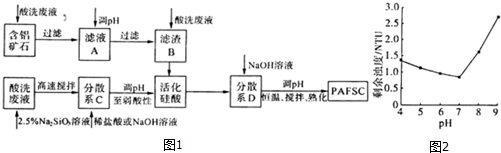
①适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,原因是调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp;(或调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动)(请用沉淀溶解平衡的理论解释).
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+.
③25℃时,PAFSC的除浊效果随溶液pH的变化如图2所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是b(填下列序号字母).
a.4~5 b.5~7 c.7~8d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了聚沉现象.
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔
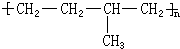 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别