题目内容
【题目】资源化利用CO2,可以减少温室气体排放,还可以获得燃料或重要的化工产品。回答下列问题:
(1)CO2的捕集
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式_____________。
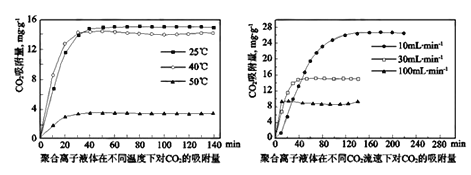
②聚合离子液体是目前广泛研究的CO2吸附剂。结合图像分析聚合离子液体吸附CO2的有利条件是_________________________。
(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式___________________________。该反应化学平衡常数K的表达式:_________________________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:
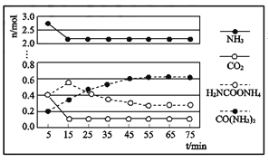
已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到___________min时到达平衡
(3)合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
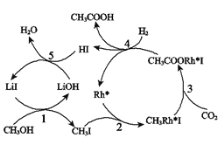
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式_______________________。
②根据图示,写出总反应的化学方程___________。
【答案】H2O + CO32- + CO2=2HCO3- 低温,低流速 2NH3(g)+ CO2(g)CO(NH2)2(s)+ H2O(g)△H= -43kJ·mol-1 K=[H2O]/[NH3]2.[CO2] 二 55 CO2 + 6e- + 6H+ = CH3OH + H2O CH3OH + CO2 + H2![]() CH3COOH + H2O
CH3COOH + H2O
【解析】
(1)①H2O、CO32-、CO2反应生成HCO3-;
②根据图知,温度越低、流速越小吸附量越大;
(2)利用盖斯定律求解热化学方程式;K等于气体生成物浓度幂之积与气体反应物浓度幂之积的比;
②达到平衡时时间越长,反应速率越慢,慢反应决定整个反应速率;各物质的物质的量不变时反应达到平衡状态;
(3)①电解时,CO2失电子和H+反应生成CH3CH2OH;
②根据图知,反应物是CH3CH2OH、CO2和H2,生成物是CH3COOH和水,LiI和Rh作催化剂。
(1)①H2O、CO32-、CO2反应生成HCO3-,离子方程式为H2O+CO32-+CO2=2HCO3-;
②根据图知,温度越低、流速越小吸附量越大,所以聚合离子液体吸附CO2的有利条件是低温,低流速(或25℃,10mL·min-1);
(2)①将第一步和第二步方程式相加得到方程式2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H=(-159.5+116.5)kJ·mol-1=-43kJ·mol-1;化学平衡常数K等于气体生成物浓度幂之积与气体反应物浓度幂之积的比,![]() ;
;
②达到平衡时时间越长,反应速率越慢,慢反应决定整个反应速率。根据图知,第一步的反应,的反应物NH3和CO2的量迅速达到定值,说明第一步反应速率大,第二步反应较慢,所以第二步决定整个反应速率;根据图知,55min各物质的物质的量不变,反应达到平衡状态;
(3)①电解时,CO2失电子和H+反应生成CH3OH,电极反应式为CO2+6e-+6H+=CH3OH+H2O;
②根据图知,反应物是甲醇、二氧化碳和氢气,生成物是乙酸和水,LiI和Rh作催化剂,总反应方程式为:CH3OH+CO2+H2![]() CH3COOH+H2O。
CH3COOH+H2O。