题目内容
【题目】NH3是一种重要的化工原料,利用NH3催化氧化并释放出电能(氧化产物为无污染性气体),其工作原理示意图如下。下列说法正确的是
A.电极Ⅰ为正极,电极上发生的是氧化反应
B.电极Ⅰ的电极反应式为2NH36e![]() N2+6H+
N2+6H+
C.电子通过外电路由电极Ⅱ流向电极Ⅰ
D.当外接电路中转移4 mol e时,消耗的O2为22.4 L
【答案】B
【解析】
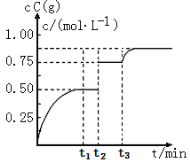
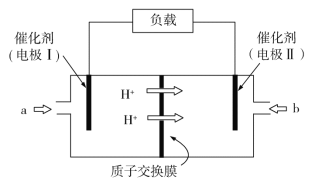
由工作原理示意图可知,H+从电极Ⅰ流向Ⅱ,可得出电极Ⅰ为负极,电极Ⅱ为正极,电子通过外电路由电极Ⅰ流向电极Ⅱ,则电极Ⅰ处发生氧化反应,故a处通入气体为NH3,发生氧化反应生成N2,电极反应式为2NH36e==N2+6H+,b处通入气体O2,O2得到电子与H+结合生成H2O,根据电极反应过程中转移的电子数进行计算,可得出消耗的标况下的O2的量。
A.由分析可知,电极Ⅰ为负极,电极上发生的是氧化反应,A项错误;
B.电极Ⅰ发生氧化反应,NH3被氧化成为无污染性气体,电极反应式为2NH36e![]() N2+6H+,B项正确;
N2+6H+,B项正确;
C.原电池中,电子通过外电路由负极流向正极,即由电极Ⅰ流向电极Ⅱ,C项错误;
D.b口通入O2,在电极Ⅱ处发生还原反应,电极反应方程式为:O2+4e-+4H+==2H2O,根据电极反应方程式可知,当外接电路中转移4 mol e时,消耗O2的物质的量为1mol,在标准状况下是22.4 L,题中未注明为标准状况,故不一定是22.4 L,D项错误;
答案选B。

练习册系列答案
相关题目