题目内容
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置,这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。________
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于__,即(填计算式)____;Na+的个数等于____,即(填计算式)____。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
【答案】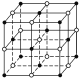 12 4 12×
12 4 12×![]() +1=4 4 8×
+1=4 4 8×![]() +6×
+6×![]() =4
=4 ![]()
![]() cm
cm
【解析】
(1)氯化钠晶体中钠离子、氯离子的配位数都是6;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个;
(3)根据均摊法求得每个晶胞中离子的个数;
(4)根据NaCl的摩尔质量为Mr gmol-1及密度为ρ gcm-3,求得晶胞的体积,进而求得棱边长,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,据此答题。
(1)氯化钠晶体中,钠离子或氯离子的配位数都是6,氯化钠晶体的结构示意图为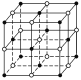 ;
;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个;
(3)根据均摊法:①处于顶点的离子,同时为8个晶胞共有,每个离子有![]() 属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有
属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有![]() 属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有
属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有![]() 属于晶胞;④处于晶胞内部(体心)的离子,则完全属于该晶胞。由此可知,在NaCl晶胞中,含Cl-:12×
属于晶胞;④处于晶胞内部(体心)的离子,则完全属于该晶胞。由此可知,在NaCl晶胞中,含Cl-:12×![]() +1=4个;含Na+:8×
+1=4个;含Na+:8×![]() +6×
+6×![]() =4个;
=4个;
(4)设晶胞边长为a,在NaCl晶胞中,含Cl-4个;含Na+4个,根据密度公式ρ=![]() ,可得a=
,可得a=![]() ,所以晶胞面对角线长为
,所以晶胞面对角线长为![]()
![]() ,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为
,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为![]()
![]() 。
。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1