题目内容
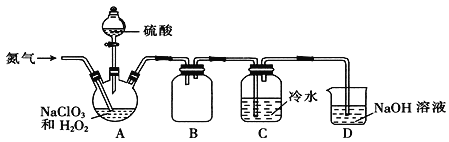
【题目】根据如图所示装置回答以下问题。

(1)利用如图装置可以验证元素非金属性的变化规律。图中D装置的名称是__,其作用是___。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2、Na2SO3、Na2CO3、H2O2、H2SO4,请选择合适药品设计实验验证氯的非金属性强于硫:装置B中发生反应的化学方程式为:__,装置C中发生的离子方程式为:__。
(3)若要用此装置证明非金属性:S>C>Si,从以下所给物质中选择药品设计实验:①稀盐酸②稀H2SO4③CaCO3④Na2CO3⑤Na2SiO3溶液⑥SiO2。试剂B与C分别为___(填序号);装置C中发生反应的离子方程式为:___。
【答案】(球形)干燥管 防倒吸 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O Cl2+S2-=S↓+2Cl- ④、⑤ CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]()
【解析】
利用此装置证明元素的非金属性强弱,需比较最高价氧化物的水化物的酸性强弱,或通过单质与非金属阴离子的置换反应来证明。左边装置中,没有加热装置,若用于制氯气,需选择不需加热就能发生反应的药品;若用于制二氧化碳,则在选择硫酸的前提下,另一药品必须易溶于水,否则与硫酸的反应不能持续进行。
(1)图中D装置是一个下端接一段玻璃管的干燥管,其名称是(球形)干燥管,因为有些气体会溶于水产生倒吸,所以其作用是防倒吸。答案为:(球形)干燥管;防倒吸;
(2)验证氯的非金属性强于硫,应利用Cl2与Na2S发生置换反应,装置B中药品应选择KMnO4、浓盐酸,发生反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,装置C中发生的化学反应方程式为Cl2+Na2S=S↓+2NaCl,离子方程式为:Cl2+S2-=S↓+2Cl-。答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+S2-=S↓+2Cl-;
(3)若要用此装置证明非金属性:S>C>Si,则需发生两组反应,一组是H2SO4与Na2CO3反应,另一组是CO2通入Na2SiO3溶液中,所以试剂B与C分别为④、⑤;装置C中发生反应的离子方程式为:CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]() 。答案为:④、⑤;CO2+H2O+
。答案为:④、⑤;CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1