题目内容
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
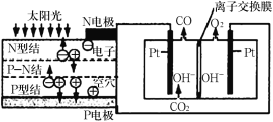
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
【答案】B
【解析】
A. 电解饱和食盐水的化学方程式为:2NaCl+2H2O![]() 2NaOH+Cl2
2NaOH+Cl2![]() +H2
+H2![]() ,反应中氯元素的化合价由-1价升高为0价,得到0.4molNaOH时,生成0.2molCl2,转移电子数为0.4NA,氢氧燃料电池正极的电极反应式为:O2+2H2O+4e-=4OH-,因此正极上消耗氧气分子数为0.1 NA ,故A错误;
,反应中氯元素的化合价由-1价升高为0价,得到0.4molNaOH时,生成0.2molCl2,转移电子数为0.4NA,氢氧燃料电池正极的电极反应式为:O2+2H2O+4e-=4OH-,因此正极上消耗氧气分子数为0.1 NA ,故A错误;
B. 1个H3O+中含有10个电子,因此2mol H3O+中含有的电子数为20 NA ,故B正确;
C. N2与H2反应的化学方程式为:N2+3H2![]() 2NH3,该反应属于可逆反应,因此密闭容器中1mol N2 (g)与3molH2(g)反应生成氨气物质的量小于2mol,形成N-H键的数目小于6 NA,故C错误;
2NH3,该反应属于可逆反应,因此密闭容器中1mol N2 (g)与3molH2(g)反应生成氨气物质的量小于2mol,形成N-H键的数目小于6 NA,故C错误;
D. 32g N2H4物质的量为![]() =1mol,两个氮原子间有一个共用电子对,每个氮原子与氢原子间有两个共用电子对,因此1mol N2H4中含有的共用电子对数为5 NA,故D错误;
=1mol,两个氮原子间有一个共用电子对,每个氮原子与氢原子间有两个共用电子对,因此1mol N2H4中含有的共用电子对数为5 NA,故D错误;
故选B。

练习册系列答案
相关题目