题目内容
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是 ( )
| A.原溶液中c(Br-)=0.4mol/L | B.反应后溶液中c(Fe3+)=c(Fe2+) |
| C.反应后溶液中c(Fe3+)=0.1mol/L | D.原溶液的浓度为0.1mol/L |
C
解析试题分析:还原性Fe2+>Br-,所以FeBr2溶液中通入Cl2,Cl2先将Fe2+氧化为Fe3+,Fe2+反应完毕,若Cl2有剩余,剩余Cl2再将Br-氧化为Br2,最后溶液中含有Br-,说明Cl2完全反应,转化为Cl-。1.12L(标态下)Cl2的物质的量为0.05mol,且溶液中c(Br-)=3c(Cl-)=0.3mol/L。若溶液中Br-参加反应,令溶液中FeBr2物质的量为xmol,则根据电子转移守恒,x+(2x-0.3)=0.1,解得x=2/15mol,2/15molmolFe2+的提供电子为2/15mol大于0.05molCl2能够获得电子0.1mol,且(2x-0.3)<0,不符合题意。若溶液中Br-未参加反应,则原溶液中的Fe2+物质的量为0.15mol,0.15molFe2+能够提供电子0.15mol,0.05molCl2能够获得电子0.1mol,小于0.15molFe2+能够提供电子0.15mol,Fe2+有剩余,符合题意,所以原溶液含有FeBr20.15mol,根据电子转移守恒,被氧化的Fe2+为0.05mol×2=0.1mol,生成Fe3+为0.1mol,剩余Fe2+为0.15mol-0.1mol=0.05mol。故选择C选项。
考点:氧化还原反应的计算

氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
| A.既不是氧化剂也不是还原剂 | B.是氧化剂 |
| C.是还原剂 | D.既是氧化剂又是还原剂 |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为
| A.1∶1 | B.3∶1 | C.5∶1 | D.7∶1 |
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是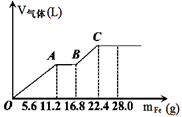
| A.原混合酸中NO3-的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2mol/L |
| C.OA段与BC段反应中电子转移的物质的量之比为2:1 |
| D.取20mL原混合酸加水稀释至1L后溶液的pH=1 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
| A.0.448 L | B.0.672 L | C.0.896 L | D.0.224 L |
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是 ( )
| A.KClO3是氧化剂 |
| B.发生氧化反应与还原反应的氯元素的质量比为5:1 |
| C.H2SO4既不是氧化剂又不是还原剂 |
| D.1mol KClO3参加反应时有10mol电子转移 |
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+。现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42—、Cl—外,还含有( )
| A.Zn2+、Fe3+、Cu | B.Cu2+、Fe3+、Zn |
| C.Zn2+、Cu2+、Fe2+、Fe | D.Zn2+、Fe2+、Cu2+、Cu |
在氧化还原反应中,下列各组物质均可用作氧化剂的是( )
| A.F—、I—、S2— | B.Fe3+、MnO4—、NO3— |
| C.ClO4—、Mg | D.Cl2、Fe3+、Al |