题目内容
有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为
| A.1∶1 | B.3∶1 | C.5∶1 | D.7∶1 |
C
解析试题分析:根据原子守恒和电荷守恒确定空缺的物质为5X-,反应中5X-化合价升高被氧化生成氧化产物5/2X2,XO3-被还原成成还原产物1/2X2,故答案为C。
考点:考查氧化还原反应基本原理有关问题。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
| A.Fe2O3跟稀硝酸反应 | B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 | D.Al(OH)3跟稀硝酸反应 |
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
下列反应肯定不属于氧化还原反应的是
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
| A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数) |
| B.NH5中既有共价键、又有离子键,是离子晶体 |
| C.NH5跟水的反应是氧化还原反应 |
| D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
已知Fe3O4可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ +2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O 下列说法不正确的是( )
| A.O2是氧化剂,S2O32-、Fe2+是还原剂 |
| B.当有1 mol Fe3O4 生成时共转移的电子为4mol |
| C.若有3mol Fe2+参加反应,则被Fe2+还原的O2为1mol |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是 ( )
| A.原溶液中c(Br-)=0.4mol/L | B.反应后溶液中c(Fe3+)=c(Fe2+) |
| C.反应后溶液中c(Fe3+)=0.1mol/L | D.原溶液的浓度为0.1mol/L |
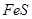 与一定浓度的
与一定浓度的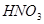 反应,生成
反应,生成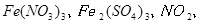
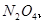
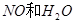 ,当
,当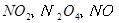 的物质的量之比为
的物质的量之比为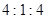 时,实际参加反应的
时,实际参加反应的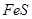 与
与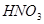 的物质的量之比为( )。
的物质的量之比为( )。
| A.1:6 | B.2:15 | C.2:3 | D.16:25 |
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )
| A.2:1混合的Pb3O4、PbO |
| B.1:2混合的PbO2、Pb3O4 |
| C.1:4:1混合的PbO2、Pb3O4、PbO |
| D.1:1:4混合的PbO2、Pb3O4、PbO |