题目内容
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是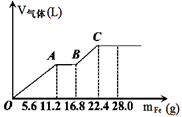
| A.原混合酸中NO3-的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2mol/L |
| C.OA段与BC段反应中电子转移的物质的量之比为2:1 |
| D.取20mL原混合酸加水稀释至1L后溶液的pH=1 |
C
解析试题分析:硝酸是氧化性酸,因此首先与铁反应,即OA段表示铁与硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++2H2O+NO↑。当NO3-完全被还原后继续介入铁粉,铁离子开始氧化铁粉,即AB段的离子方程式为Fe+2Fe3+=3Fe2+。最后加入铁粉氢离子与铁发生置换反应生成氢气,即BC段反应的离子方程式为Fe+2H+=F2+H2↑,据此可以判断。A、碘A时溶液中的NO3-尾气被还原为NO,此时消耗铁的质量是11.2g,物质的量=11.2g÷56g/mol=0.2mol,则根据方程式可知消耗NO3-的物质的量是0.2mol,所以原混合酸中NO3-的物质的量为0.2 mol,故A正确;B、最终消耗铁的质量是22.4g,物质的量=22.4g÷56g/mol=0.4mol。因此最终生成硫酸亚铁的物质的量是0.4mol。则根据原子守恒可知,硫酸的物质的量是0.4mol,则硫酸的浓度=0.4mol÷0.2L=2.0mol/L,B正确;C、OA段消耗0.2mol铁,转移0.2mol×3=0.6mol电子。BC阶段消耗铁的质量是22.4g-16.8g=5.6g,物质的量是0.1mol,则转移0.1mol×2=0.2mol电子。所以OA段与BC段反应中电子转移的物质的量之比为3:1,故C错误;D、原混合酸硝酸和硫酸的物质的量分别是0.2mol和0.4mol,其中氢离子的物质的量是0.2mol+0.4mol×2=1.0mol,则氢离子的浓度=1.0mol/L÷0.2L=5mol/L。所以取20mL原混合酸加水稀释至1L后溶液中氢离子的浓度= ×5mol/L=0.1mol/L,则溶液的pH=1,故D正确,答案选C。
×5mol/L=0.1mol/L,则溶液的pH=1,故D正确,答案选C。
考点:考查铁与硝酸和硫酸混合液反应的有关计算以及图像分析与判断

 轻松暑假总复习系列答案
轻松暑假总复习系列答案下列化学变化中,必须加入氧化剂才能实现的是
| A.SO2→H2SO3 | B.Cl2→NaClO | C.Fe→FeCl2 | D.HNO3→O2 |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.1mol KClO3参加反应,转移的电子为1mol |
| D.H2C2O4的氧化性强于ClO2的氧化性 |
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
| A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数) |
| B.NH5中既有共价键、又有离子键,是离子晶体 |
| C.NH5跟水的反应是氧化还原反应 |
| D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 | B.HF是还原产物 |
| C.还原剂和氧化剂的物质的量之比是2:1 | D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是 ( )
| A.原溶液中c(Br-)=0.4mol/L | B.反应后溶液中c(Fe3+)=c(Fe2+) |
| C.反应后溶液中c(Fe3+)=0.1mol/L | D.原溶液的浓度为0.1mol/L |
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( )
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
在相同条件下的三个反应: 2A- +B2 =2B- +A2; 2C- +A2 =2A- +C2; 2B- +D2 =2D- +B2,下列判断不正确的是( )
| A.氧化性: B2> A2 | B.还原性: C- > D- |
| C.2A- +D2 =2D- + A2反应可以进行 | D.2C- +B2 =2B- + C2反应不能进行 |
下列变化中,必须加入氧化剂才能发生的是( )
| A.SO2→S | B.SO32-→SO2 | C.Fe2+→Fe3+ | D.HCO3-→CO32- |