题目内容
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+。现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42—、Cl—外,还含有( )
| A.Zn2+、Fe3+、Cu | B.Cu2+、Fe3+、Zn |
| C.Zn2+、Cu2+、Fe2+、Fe | D.Zn2+、Fe2+、Cu2+、Cu |
D
解析试题分析:由于氧化性:Fe3+>Cu2+>Fe2+>Zn2+,所以将等物质的量的CuSO4、FeCl3和Zn于水中,首先发生反应:Zn+2Fe3+=2Fe2++Zn2+,然后发生:Zn+Cu2+=Zn2++Cu。根据反应方程式在个物质的关系科知所得混合物中除了SO42—、Cl—外,还含有Zn2+、Fe2+、Cu2+、Cu。选项为:D.
考点:考查氧化性、还原性的强弱及氧化还原反应的先后顺序。

氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是 ( )
| A.原溶液中c(Br-)=0.4mol/L | B.反应后溶液中c(Fe3+)=c(Fe2+) |
| C.反应后溶液中c(Fe3+)=0.1mol/L | D.原溶液的浓度为0.1mol/L |
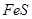 与一定浓度的
与一定浓度的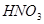 反应,生成
反应,生成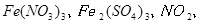
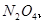
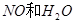 ,当
,当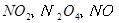 的物质的量之比为
的物质的量之比为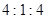 时,实际参加反应的
时,实际参加反应的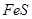 与
与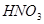 的物质的量之比为( )。
的物质的量之比为( )。
| A.1:6 | B.2:15 | C.2:3 | D.16:25 |
在相同条件下的三个反应: 2A- +B2 =2B- +A2; 2C- +A2 =2A- +C2; 2B- +D2 =2D- +B2,下列判断不正确的是( )
| A.氧化性: B2> A2 | B.还原性: C- > D- |
| C.2A- +D2 =2D- + A2反应可以进行 | D.2C- +B2 =2B- + C2反应不能进行 |
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是( )
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )
| A.2:1混合的Pb3O4、PbO |
| B.1:2混合的PbO2、Pb3O4 |
| C.1:4:1混合的PbO2、Pb3O4、PbO |
| D.1:1:4混合的PbO2、Pb3O4、PbO |
下列反应类型的判断,不正确的是( )
A.CO2+H2O H2CO3化合反应 H2CO3化合反应 |
B.Cu(OH)2 CuO+H2O 分解反应 CuO+H2O 分解反应 |
C.MnO2+2CO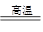 Mn+2CO2置换反应 Mn+2CO2置换反应 |
| D.NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |