题目内容
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
| A.0.448 L | B.0.672 L | C.0.896 L | D.0.224 L |
B
解析试题分析:发生的反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O据题上的数据NO3-不足量,按NO3-的量计算,故产生的NO的体积为2×10×103×22.4=0.448L反应消耗H+0.08mol,剩余0.02molH+再与过量的Fe发生的反应为:Fe+2H+=H2↑故又生成0.01mol的H2故气体的总体积为0.672L,故B正确。
考点:考查物质的性质、计算等相关知识。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应NH3被还原 | D.生成1 mol N2有6 mol电子转移 |
下列反应肯定不属于氧化还原反应的是
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
已知Fe3O4可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ +2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O 下列说法不正确的是( )
| A.O2是氧化剂,S2O32-、Fe2+是还原剂 |
| B.当有1 mol Fe3O4 生成时共转移的电子为4mol |
| C.若有3mol Fe2+参加反应,则被Fe2+还原的O2为1mol |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是 ( )
| A.原溶液中c(Br-)=0.4mol/L | B.反应后溶液中c(Fe3+)=c(Fe2+) |
| C.反应后溶液中c(Fe3+)=0.1mol/L | D.原溶液的浓度为0.1mol/L |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
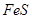 与一定浓度的
与一定浓度的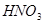 反应,生成
反应,生成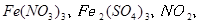
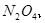
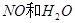 ,当
,当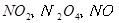 的物质的量之比为
的物质的量之比为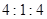 时,实际参加反应的
时,实际参加反应的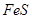 与
与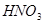 的物质的量之比为( )。
的物质的量之比为( )。
| A.1:6 | B.2:15 | C.2:3 | D.16:25 |
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+KCl,则下列有关叙述错误的是
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.该反应氧化剂与还原剂物质的量之比为6:5 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |