题目内容
【题目】在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g)![]() CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的![]() ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
【答案】(1)1.2mol/(L·min)
(2)=75%
(3)0.1875(mol/L)-2
【解析】
设变化的CO的物质的量为x:
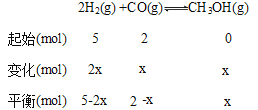
利用PV=nRT,在恒温、恒容下,物质的量之比等于压强之比,则平衡时混合气的总物质的量为![]() (5+2)=4mol,所以(5-2x)+(2-x)+x=4,x=1.5 mol
(5+2)=4mol,所以(5-2x)+(2-x)+x=4,x=1.5 mol
则平衡时各物质的浓度分别为c(H2)=4mol/L,c(CO)=1mol/L,c(CH3OH)=3mol/L。
(1)υ(H2)=![]() =1.2 mol/(L·min)
=1.2 mol/(L·min)
(2)CO的转化率=![]() ×100%=75%
×100%=75%
(3)K=![]() =
=![]() =0.1875(mol/L)-2
=0.1875(mol/L)-2

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目