题目内容
【题目】化合物F是一种重要有机物,其合成路线如下:
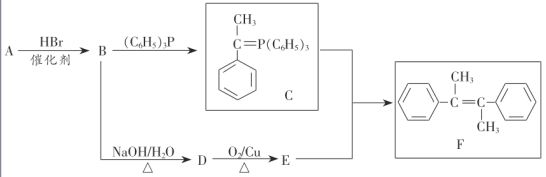
已知:①烃A的相对分子质量为104;
②E的核磁共振氢谱有4组吸收峰;
③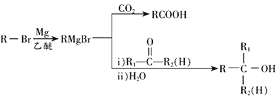
请回答以下问题:
⑴A的化学名称为________,E中官能团名称是________
⑵B→D的反应类型为________,F中共平面的碳原子最多有________个.
⑶D→E的化学方程式为________
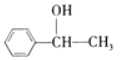
⑷上述流程中可能得到一种与E互为同分异构体的副产物,该物质的结构简式为________
⑸D的一种同分异构体X,能与FeCl3溶液发生显色反应,则X共有________种.![]() 不含立体异构
不含立体异构![]()
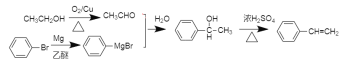
⑹参照题干有关信息,设计一条由溴苯和乙醇为原料制备A的合成路线:________(其他无机试剂和溶剂任选)
【答案】苯乙烯 羰基 取代反应或水解反应 16 ![]()
![]()
![]()
![]()
![]()
【解析】
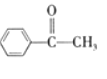
根据条件分析,B为溴代烃,D为醇,E为醛或酮,由E的核磁共振有4组吸收峰推出,E为 ,D为:
,D为: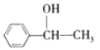 。
。
⑴根据烃A的相对分子质量为104,且含苯环,苯环外有两个碳原子推断出,根据D到E反应和E中有四种氢得出。
⑵B→D为卤代烃的水解反应,也属于取代反应;F中两个苯环相当于取代了中间乙烯中两个氢来分析。
⑶D→E反应为醇的催化氧化。
⑷A与HBr加成,溴加的位置不同,产物不相同。
⑸符合与FeCl3溶液发生显色反应的同分异构体X为酚类,环外两个碳形成的取代基可能为一个乙基或两个甲基,再根据书写同分异构体来分析。
⑹乙醇被催化氧化变为乙醛,溴苯和镁、乙醚反应生成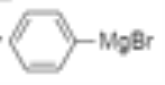 ,
,![]() 和乙醛反应生成
和乙醛反应生成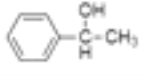 ,再浓硫酸加热发生消去反应即可得路线图。
,再浓硫酸加热发生消去反应即可得路线图。
⑴烃A的相对分子质量为104,且含苯环,苯环外有两个碳原子,可知分子式为C8H8,结合与HBr发生加成反应,推测A为苯乙烯,E中官能团名称是羰基,故答案为:苯乙烯;羰基。
⑵B→D为卤代烃的水解反应,也属于取代反应;F的分子式为C16H16,相当于乙烯分子的四个氢原子分别被两个甲基两个苯基取代,故最多16个碳原子共面;故答案为:取代反应或水解反应;16。
⑶D→E的化学方程式为:2
![]()

![]() ;故答案为:
;故答案为:![]()

![]()

![]() 。
。
⑷A与HBr加成的产物除了![]() ,还有产物
,还有产物![]() ,后者经水解、催化氧化得到:
,后者经水解、催化氧化得到:![]() ;故答案为:
;故答案为:![]() 。
。
⑸符合与FeCl3溶液发生显色反应的同分异构体X为酚类,环外两个碳形成的取代基可能为一个乙基或两个甲基,前者一个乙基与酚羟基有邻、间、对三种结构;后者先写出邻、间、对三种二甲苯,再把酚羟基插入苯环上,有6种结构,故X共有9种结构;
⑹乙醇被催化氧化变为乙醛,溴苯和镁、乙醚反应生成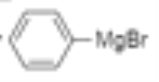 ,
,![]() 和乙醛反应生成
和乙醛反应生成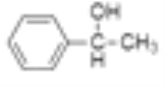 ,再浓硫酸加热发生消去反应,因此整个A的合成路线:
,再浓硫酸加热发生消去反应,因此整个A的合成路线: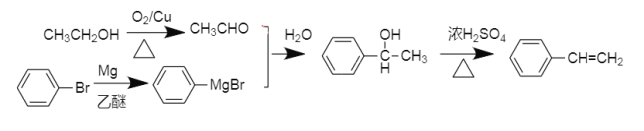 ,故答案为:
,故答案为: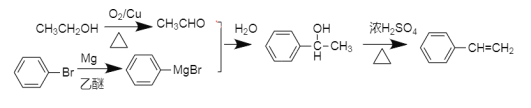 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
【题目】下列说法中不正确的是( )
弱酸 | CH3COOH | HClO | H2CO3 |
电离平衡常数(25℃) | K1=1.760×10-5 | K1=2.95×10-8 | K1=4.30×10-7 K2=5.60×10-11 |
A.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①
B.一定浓度的NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1
D.少量的![]() 通入NaClO溶液中发生反应:
通入NaClO溶液中发生反应:![]()
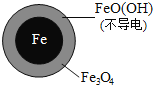
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
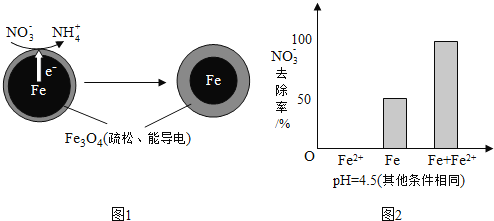
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液