��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g�� ��H1
CH3OH(g�� ��H1
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g�� ��H2
CH3OH(g)+H2O(g�� ��H2
��CO2(g)+H2(g)![]() CO(g)+H2O(g�� ��H3
CO(g)+H2O(g�� ��H3
�ش��������⣺
��1����֪��H1��-99kJ��mol-1 ����H3��+41kJ��mol-1������H2��_________kJ��mol-1��
��2����Ӧ���Ļ�ѧƽ�ⳣ��K�ı���ʽΪ____________��ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ_______�������߱����ĸ�������ж�������________��
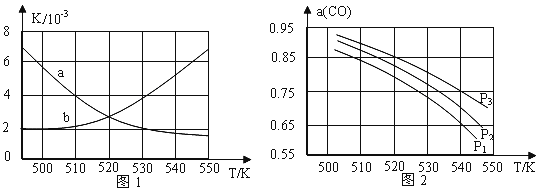
��3������ʼ����������ʵ���һ��ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��������CO��ֵ���¶����߶�_____������������������С������ͼ2�е�ѹǿ�ɴ�СΪ_____________�����ж�������____________��
���𰸡�-58 ![]() a ��Ӧ��Ϊ���ȷ�Ӧ���¶����ߣ�ƽ�����ƣ�ƽ�ⳣ����С ��С P3��P2��P1 ��Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ��ƽ�����ƣ�CO��ת����������Ӧ��Ϊ�������������ķ�Ӧ����ѹ��ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬������ѹǿ��CO��ת��������
a ��Ӧ��Ϊ���ȷ�Ӧ���¶����ߣ�ƽ�����ƣ�ƽ�ⳣ����С ��С P3��P2��P1 ��Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ��ƽ�����ƣ�CO��ת����������Ӧ��Ϊ�������������ķ�Ӧ����ѹ��ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬������ѹǿ��CO��ת��������
��������
��1�����ݸ�˹���ɣ���Ӧ��-��Ӧ��=��Ӧ��������H2=��H3+��H1=��+41kJ��mol-1��+��-99kJ��mol-1��=-58kJ��mol-1��
��2����Ӧ��CO��g��+2H2��g��CH3OH��g����ƽ�ⳣ������ʽ![]() ����Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������a��ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ��
����Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������a��ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ��
��3����ͼ��֪��ѹǿһ��ʱ�����¶ȵ����ߣ�CO��ת���ʼ�С����Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����ʹƽ����ϵ��CO�������ܽ�������¶����ߣ�CO��ת���ʼ�С��
��ͬ�¶��£���Ӧ��ǰ��������������䣬ѹǿ�ı䲻Ӱ����ƽ���ƶ�����Ӧ������ӦΪ�����������С�ķ�Ӧ������ѹǿ��������ƽ��������Ӧ�����ƶ���CO��ת������������ѹǿ������CO��ת�������ߣ���ѹǿ��P1��P2��P3��

����Ŀ����Na2FeO4��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

ʵ���� | �¶ȣ�K�� | pH |
�� | 298 | 1 |
�� | 310 | 1 |
�� | 298 | 7 |
�� | 298 | 2 |
A.ʵ�����15min��M�Ľ�������Ϊ1.33��10-5mol��L-1��min-1
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.������������ͬ��ʵ��٢�˵��M��Ũ��ԽС�����������Խ��
����Ŀ��Ŀǰ������̼���������ܹ�ע��![]() �IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⣮
�IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⣮
![]() ��Ũ
��Ũ![]() ��Һ��ͨ��
��Һ��ͨ��![]() ��
��![]() �������Ƶ�����̼���
�������Ƶ�����̼���![]() ����ֱ����
����ֱ����![]() ֮��
֮��![]() ����Ũ
����Ũ![]() ��Һ��ͨ��
��Һ��ͨ��![]() ��
��![]() ����������̼���ʱ��Ӧ��ͨ��
����������̼���ʱ��Ӧ��ͨ��![]() ����ͨ��
����ͨ��![]() �Ʊ�����̼��Ƶ����ӷ���ʽΪ ______ ���жϲ�Ʒ���Ƿ�������̼��Ƶ�ʵ�鷽��Ϊ ______ ��
�Ʊ�����̼��Ƶ����ӷ���ʽΪ ______ ���жϲ�Ʒ���Ƿ�������̼��Ƶ�ʵ�鷽��Ϊ ______ ��
![]() �������£�
�������£�![]() ��
��![]() ��Ӧ��������
��Ӧ��������![]() ��
��![]() ��
��![]() ��
��![]() �ֱ�����ס��������ܱ������У�������Ӧ��
�ֱ�����ס��������ܱ������У�������Ӧ��![]() ��������������±���ʾ��
��������������±���ʾ��
���� | �ݻ� | �¶� | ��ʼ�� | ƽ���� | �ﵽƽ������ʱ�� | |
|
|
| ||||
�� | 2 |
| 2 | 4 |
| 8 |
�� | 1 |
| 1 | 2 |
| 3 |
��![]() ʱ���÷�Ӧ��ƽ�ⳣ��
ʱ���÷�Ӧ��ƽ�ⳣ��![]() ______
______
���������У�����Ӧ���е�![]() ʱ��
ʱ��![]() �����ʵ���Ũ�� ______
�����ʵ���Ũ�� ______ ![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.![]()
![]()
![]()
![]()
�۱��������ݻ�Ϊ1L��![]() ʱ����ʼ����amol
ʱ����ʼ����amol![]() ��bmol
��bmol![]() ����Ӧ�ﵽƽ��ʱ�����
����Ӧ�ﵽƽ��ʱ�����![]() ��ת���ʴ���
��ת���ʴ���![]() ��ת���ʣ���
��ת���ʣ���![]() ��ֵ�����������Ϊ ______ ��
��ֵ�����������Ϊ ______ ��
�ܶ��������ݻ�Ϊ1L��![]() ʱ����������ȳ���
ʱ����������ȳ���![]() ��
��![]() ��
��![]() ��
��![]() ���ﵽƽ��ʱ�����������������������ȫ��ͬ���� ______
���ﵽƽ��ʱ�����������������������ȫ��ͬ���� ______ ![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.![]() ��
��![]() ��
��![]() ��
��![]()
B.![]() ��
��![]() ��O
��O
C.![]() ��
��![]() ��
��![]() ��
��![]()
D.![]() ��
��![]() ��
��![]() ��
��![]()
![]() ��һ�������¿�ת��Ϊ����
��һ�������¿�ת��Ϊ����![]() �ü���ȼ�ϵ������Դ���ö��Ե缫���ⱥ��
�ü���ȼ�ϵ������Դ���ö��Ե缫���ⱥ��![]() ��Һ����ȡ
��Һ����ȡ![]() ��KOH��ʵ��װ����ͼ��ʾ
��KOH��ʵ��װ����ͼ��ʾ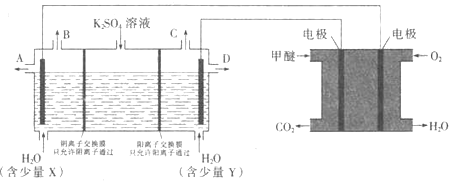
�ټ���ȼ�ϵ�صĸ�����ӦʽΪ ______
��![]() �ڵ���������Ϊ ______
�ڵ���������Ϊ ______ ![]() �ѧʽ
�ѧʽ![]() ��
��
����ȼ�ϵ��ͨ��![]() ������Ϊ
������Ϊ![]() ��2minʱ��������C���ռ�����״������������Ϊ ______ ��
��2minʱ��������C���ռ�����״������������Ϊ ______ ��
����Ŀ��N2O5��һ��������������һ���¶��·�����Ӧ2N2O5(g)4NO2(g)��O2(g)����H>0, T1�¶��µIJ���ʵ���������±���ʾ��
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
����˵����ȷ����
A. �÷�Ӧ���κ��¶��¾����Է�����
B. T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱN2O5(g)ת����Ϊ50%
C. ������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1>T2����K1<K2
����Ŀ��������������Դ�������ȷ������Ź㷺����;��ʪ�����ɷ��Ʊ��������ε�ԭ�����±���ʾ��
ʪ�� | ǿ���Խ����У�Fe(NO3)3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
�ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |
(1)��ҵ����ʪ���Ʊ��������(K2FeO4)��������ͼ��ʾ��
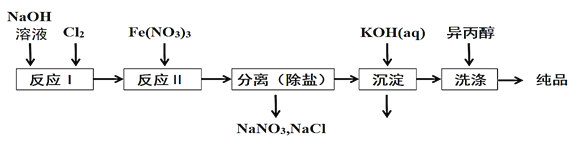
��ϴ�Ӵ�Ʒʱѡ�������������ˮ�������ǣ�________��
�ڷ�ӦII�����ӷ���ʽΪ___________��
�۸��������ˮ�м�������ɱ�������ܾ�ˮ����һ�������ˮ������.��������ɱ������Ϊ_______���ܾ�ˮ��ԭ����_______��
(2)������ͼ�ɼ���ʪ���Ʊ��������ʱ�������Ƶø������ƣ�Ȼ��������������м��뱥��KOH��Һ����������������ء�
�ټ��뱥��KOH��Һ��Ŀ���ǣ�__________��
����������Ϣ��֪��������ص��ܽ�ȱȸ�������____(������������С��)��
(3)�ɷ��Ʊ�K2FeO4�ķ�Ӧ���������ͻ�ԭ�������ʵ���֮��________