题目内容
9.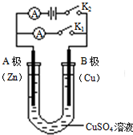 如右图所示,请按要求回答下列问题.
如右图所示,请按要求回答下列问题.(1)打开K2,合并K1.A为负(填“正”或“负”)极,在该电极可观察到的现象是A处金属不断溶解;B极的电极反应为Cu2++2e-=Cu.
(2)打开K1,合并K2.A为阴(填“阴”或“阳”)极,在该电极可观察到的现象是A上有红色金属析出;B极的电极反应为Cu-2e-=Cu2+;当有0.2mol电子转移时,则析出铜的质量为6.4g.
分析 (1)若打开K2,合并K1,形成原电池反应,A极Zn为负极,被氧化,B极Cu为正极,发生还原反应生成铜;
(2)若打开K1,合并K2,为电解池,B为阳极,A为阴极,该极上析出金属铜,根据电子守恒进行计算.
解答 解:(1)若打开K2,合并K1,形成原电池反应,A极Zn为负极,锌不断溶解,Zn-2e-=Zn2+,B极Cu为正极,发生还原反应生成铜,电极方程式为Cu2++2e-═Cu,有红色物质析出,
故答案为:负; A处金属不断溶解;Cu2++2e-=Cu;
②若打开K1,合并K2,为电解池,B为阳极,反应为Cu-2e-=Cu2+;A为阴极,该极上析出金属铜,发生Cu2++2e-═Cu,所以当有0.2mol电子转移时,则析出铜的质量为6.4g,故答案为:阴;A上有红色金属析出;Cu-2e-=Cu2+;6.4.
点评 本题考查了原电池和电解池原理,知道原电池和电解池区别,知道各个电极上发生的电极反应,再结合各个物理量之间的关系式计算,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
19.平衡体系 CaCO3(s)?CaO(s)+CO2(g) 中仅含碳酸钙、氧化钙及二氧化碳气体.某时刻保持 温度不变,往恒容密闭容器中再通一定量 CO2 气体,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | CaO 的量不变 | C. | CO2浓度不变 | D. | CO2 浓度增大 |
4.下列各组离子中,在无色透明的酸性溶液中,可以大量共存的是( )
| A. | Al3+、Na+、SO42-、Br- | B. | Na+、NH4+、NO3-、I- | ||
| C. | K+、Mg2+、Fe3+、Cl- | D. | Na+、AlO2-、SO42-、CO32- |
14.下列各组物质间不能发生反应的是( )
| A. | 铁与稀硝酸 | B. | 铁和硫酸铜溶液 | ||
| C. | 铁和氢氧化钠溶液 | D. | 铁粉与灼热的水蒸气 |
18.燃烧下列混合气体所生成的CO2的物质的量,一定大于燃烧相同质量的环丙烷产生的CO2的物质的量的是( )
| A. | 丙烯与丁烯 | B. | 丙烷与丁炔 | C. | 乙烯与乙炔 | D. | 乙烷与丙烯 |
19.将400mL0.3mol/L的FeSO4溶液加入到100mL K2Cr2O7熔液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为( )
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
