题目内容
1.在①NaCl、②Na2CO3、③NH4Cl三种盐溶液中,常温下呈酸性的是③(填写序号,下同),呈中性的是①,呈碱性的是②.分析 根据盐类水解规律”谁强谁显性、谁弱谁水解、强强显中性”来确定这三种盐溶液的酸碱性,据此分析解答.
解答 解:氯化钠为强酸强碱盐,钠离子和氯离子都不水解,所以氯化钠溶液呈中性;氯化铵为强酸弱碱盐,铵根离子水解而导致其溶液呈酸性,碳酸钠为强碱弱酸盐,碳酸根离子水解而导致其溶液呈碱性,所以常温下呈酸性的是③,呈中性的是①,呈碱性的是②,
故答案为:③;①;②.
点评 本题考查了盐溶液酸碱性判断,根据盐的类型及盐中发生水解反应的离子来确定溶液酸碱性,盐类水溶液酸碱性强弱与弱离子水解程度有关,题目较简单.

练习册系列答案
相关题目
11.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,H2的气体摩尔体积约为22.4L | |
| B. | 标准状况下,22.4L的CO2和O2组成的混合物中,含氧原子数为2NA | |
| C. | 1mol/L CaCl2溶液中含有的氯离子数目为2NA | |
| D. | 18gNH4+中含有10NA个质子 |
12.在pH=1的某溶液中,因发生氧化还原反应而不能大量共存的离子组是( )
| A. | A13+、NO3-、Fe2+ | B. | SCN-、Cl-、Fe3+ | C. | HCO3-、Al3+、Cl- | D. | Na+、K+、CO32- |
16.下列物质中不能使酸性高锰酸钾溶液褪色的是( )
| A. | CH≡CH | B. | CH2=CH2 | C. | 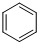 | D. | 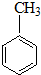 |
13.下列反应的离子方程式正确的是( )
| A. | 用氨水吸收少量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| D. | 碳酸钠溶液中慢慢滴入少量稀盐酸:CO32-+2H+═CO2↑+H2O |
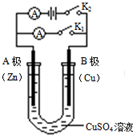 如右图所示,请按要求回答下列问题.
如右图所示,请按要求回答下列问题.

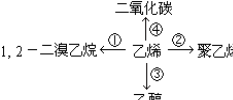
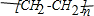 ③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.