题目内容
11.下列说法正确的是( )| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
分析 A、元素的非金属性越强,其气态氢化物越稳定;
B、H原子失去电子后没有电子,得到电子后形成最外层2个电子的稳定结构;
C、同主族从上到下金属性增强;
D、氢跟卤素结合时所形成的化学键一定是共价键.
解答 解:A、由于非金属性P大于Si,故气体氢化物的稳定性:SiH4<PH3,故A错误;
B、H原子只有一个电子,当H原子失去一个电子后没有电子,不满足8电子稳定结构,故B错误;
C、同主族从上到下金属性增强,则Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强,故C正确;
D、氢跟卤素结合时所形成的化学键一定是共价键,故D错误,故选C.
点评 关于元素周期律的考题一般难度都不大,做好该类型题目的关键是要准.要在头脑中有一个完整准确的元素周期表,这样就能准确判断元素,尽而回答出相关的问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.甲溶液的PH=4,乙溶液的PH=1,则甲溶液与乙溶液中C(H+)之比是( )
| A. | 1000 | B. | $\frac{1}{1000}$ | C. | 3 | D. | $\frac{1}{3}$ |
19.下列有关分类的观点正确的是( )
①氨水、醋酸、氢氧化铝都属于弱电解质
②生物质能、沼气和乙醉都是可再生能源
③碳素钢、不锈钢和目前流通的硬币都属于合金
④铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
⑤由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应.
①氨水、醋酸、氢氧化铝都属于弱电解质
②生物质能、沼气和乙醉都是可再生能源
③碳素钢、不锈钢和目前流通的硬币都属于合金
④铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
⑤由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ③⑤ |
6.下列说法正确的是( )
| A. | 若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的某二元弱酸盐Na2A溶液中,c(Na+)═2[c(HA-)+c(A2-)+c(H2A)] |
16.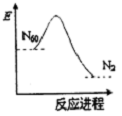 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )| A. | N60转化N2是物理变化 | B. | N2不如N60稳定 | ||
| C. | N60转化N2是吸收能量的过程 | D. | N60可能成为一种好的火箭材料 |
3.蔬菜中富含纤维素,豆类食品中富含蛋白质,各种植物种子中含有丰富的油脂.下列说法正确的是( )
| A. | 蛋白质都属于天然有机高分子化合物,且都不溶于水 | |
| B. | 用灼烧闻气味的方法可以区别人造丝(纤维素)和蚕丝 | |
| C. | 人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处 | |
| D. | 油脂是一种高分子化合物,可水解为甘油和高级脂肪酸 |
20.Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 75 mL 1 mol•L-1AlCl3溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 1 mol•L-1 NaCl溶液 | D. | 150 mL 2 mol•L-1 KCl溶液 |
1.氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
(1)吸收塔内发生反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为71克.
(2)从滤液中得到的NaClO2•3H2O晶体的操作依次是dc(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e加热蒸发 f洗涤 g 干澡
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:前者大(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时的S2-的浓度为6.3×10-13mol/L.
③为除工业废水中的Cu2+、Pb2+、Hg2+杂质离子,最适宜向此工业废水中加入过量的试剂是B
A NaOH B FeS C Na2S
已知Ksp(FeS)=6.3×10-10;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-28.

已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
(1)吸收塔内发生反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为71克.
(2)从滤液中得到的NaClO2•3H2O晶体的操作依次是dc(填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e加热蒸发 f洗涤 g 干澡
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | HS |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时的S2-的浓度为6.3×10-13mol/L.
③为除工业废水中的Cu2+、Pb2+、Hg2+杂质离子,最适宜向此工业废水中加入过量的试剂是B
A NaOH B FeS C Na2S
已知Ksp(FeS)=6.3×10-10;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-28.

 .
.