题目内容
1.在下图所示的物质转化中,A、C均为常见的金属单质,并且在冷的H的浓溶液中均会发生钝化;E为固体非金属单质.B为红色固体氧化物,X为常见无色液体.L溶液的焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去).
回答以下问题:
(1)H的化学式为H2SO4.
(2)L的电子式为
 .
.(3)A与B反应的化学方程式为Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe.
(4)K与足量的氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化,则A、C为Fe、Al,H可能为浓硫酸或浓硝酸,A、B之间的反应为铝热反应,由于B为红色固体氧化物,则B为Fe2O3,A为Al,C为Fe,D为A12O3.E为固体非金属单质,连续氧化得到G,G与常见无色液体X反应得到H,则E为S,F为SO2,G为SO3,H为H2SO4,X为H2O,I为FeSO4.L焰色为黄色,且能使酚酞变红,且能与Al2O3反应,则L为NaOH,与Al2O3反应生成J为NaAlO2,A12O3与硫酸反应生成K为Al2(SO4)3,则M为Al(OH)3,据此解答.
解答 解:A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化,则A、C为Fe、Al,H可能为浓硫酸或浓硝酸,A、B之间的反应为铝热反应,由于B为红色固体氧化物,则B为Fe2O3,A为Al,C为Fe,D为A12O3.E为固体非金属单质,连续氧化得到G,G与常见无色液体X反应得到H,则E为S,F为SO2,G为SO3,H为H2SO4,X为H2O,I为FeSO4.L焰色为黄色,且能使酚酞变红,且能与Al2O3反应,则L为NaOH,与Al2O3反应生成J为NaAlO2,A12O3与硫酸反应生成K为Al2(SO4)3,则M为Al(OH)3.
(1)由以上分析可知,H的化学式为H2SO4,故答案为:H2SO4;
(2)L为NaOH,电子式为 ,故答案为:
,故答案为: ;
;
(3)A与B反应是Al与氧化铁在高温条件下反应生成铁与氧化铝,反应的化学方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe,
故答案为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe;
(4)K为Al2(SO4)3,与足量的氨水反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物的推断,转化中特殊反应、物质的颜色等是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl(取代反应) | |
| B. | nH2C=CHCl→ (缩聚反应) (缩聚反应) | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O(氧化反应) | |
| D. | CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O(消去反应) |

| A. | 1mol该有机物最多可以和5mol NaOH反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水或氢气反应,最多消耗3mol Br2或6molH2 |
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO32- | D. | 可能会有SO42-或Ag+或SO32- |
| A. | 纯银器表面在干燥空气中因电化学腐蚀渐渐变暗 | |
| B. | 在海轮外壳连接锌块是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| A. | 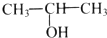 | B. | 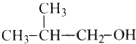 | C. | 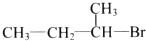 | D. | 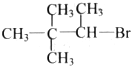 |
| 甲 | |
| 乙 | 丙 |
| A. | 原子半径:甲<乙 | |
| B. | 最外层电子数:甲>乙 | |
| C. | 最高价氧化物对应的水化物的碱性:丙>乙 | |
| D. | 金属性:丙<乙 |
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |

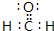 ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.
,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.