题目内容
3.蔬菜中富含纤维素,豆类食品中富含蛋白质,各种植物种子中含有丰富的油脂.下列说法正确的是( )| A. | 蛋白质都属于天然有机高分子化合物,且都不溶于水 | |
| B. | 用灼烧闻气味的方法可以区别人造丝(纤维素)和蚕丝 | |
| C. | 人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处 | |
| D. | 油脂是一种高分子化合物,可水解为甘油和高级脂肪酸 |
分析 A.相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物,淀粉、纤维素、蛋白质为天然高分子化合物,部分蛋白质可溶于水;
B.蚕丝是蛋白质;
C.虽人体内不含水解纤维素的酶,不能消化纤维素,但蔬菜中的纤维素对人体有用处;
D.高分子化合物的相对分子质量特别大,一般达1万以上、一般具有重复结构单元.
解答 解:A.蛋白质均属于天然高分子化合物,它们的相对分子质量在10000万以上,部分蛋白质可溶于水,如血清蛋白、酶等,故A错误;
B.蚕丝是蛋白质,因蛋白质灼烧时有烧焦羽毛的特殊气味,所以可用灼烧来鉴别人造丝(纤维素)和蚕丝,故B正确;
C.人类膳食中的纤维素主要含于蔬菜和粗加工的谷类中,虽然不能被消化吸收,但有促进肠道蠕动,利于粪便排出等功能,故C错误;
D.油脂相对分子质量较小,不是高分子化合物,故D错误.
故选B.
点评 本题考查蛋白质的性质,纤维素,油脂等,难度不大,注意人类膳食中的纤维素主要含于蔬菜和粗加工的谷类中,虽然不能被消化吸收,但有促进肠道蠕动,利于粪便排出等功能.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
13.下列有机物中,能发生消去反应生成两种烯烃的是( )
| A. | 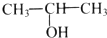 | B. | 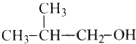 | C. | 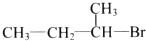 | D. | 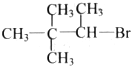 |
14.对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2中的氢元素被还原;⑤此反应中氧化产物与还原产物的原子个数之比是1:1,
上述判断中正确的是( )
上述判断中正确的是( )
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ④⑤ |
11.下列说法正确的是( )
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
18.一定温度时,在容积一定的密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI(g)?H2(g)+I2(g),下列叙述中一定表示达到化学平衡状态的是( )
| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
8.下列物质中不能与金属钠反应的是( )
| A. | 苯 | B. | 水 | C. | 氧气 | D. | 乙醇 |
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
12.将质量相同的锌粉分别投入下列4个烧杯的溶液中,反应速率最快的是( )
| A. | 含1mol HCl 500mL | B. | 含36.5g HCl 500mL | ||
| C. | 2mol•L-1 HCl 500mL | D. | 2mol•L-1 H2SO4 250mL |
13.以下素材是某课外实验小组的实验记录,请根据实验记录回答有关问题.
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
已知:Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂分子[Cu(NH3)4]2+,NH3分子可以换成气体分子或离子.
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).