题目内容
6.下列说法正确的是( )| A. | 若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的某二元弱酸盐Na2A溶液中,c(Na+)═2[c(HA-)+c(A2-)+c(H2A)] |
分析 A、根据酸越弱,对应的盐溶液水解程度越大分析;
B、NaOH为强碱,一水合氨为弱碱,稀释相同倍数时,强碱的pH变化大;
C、醋酸是弱酸,NaOH是强碱,氢离子浓度与氢氧根离子浓度相同时,醋酸浓度大于NaOH浓度;
D、H2A是二元弱酸,Na2A能够分步水解生成HA-和H2A,据物料守恒分析.
解答 解:A、酸越弱,对应的盐溶液水解程度越大,则若酸性HA>HB,则钠盐溶液的碱性NaA<NaB,故A错误;
B、NaOH为强碱,一水合氨为弱碱,加水稀释使其pH变化相同倍数时,一水合氨加水的体积大,故B错误;
C、pH=3的醋酸与pH=11的NaOH溶液等体积混合时溶液显酸性,所以溶液中离子浓度的大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、在二元弱酸盐Na2A溶液中,Na2A能够分步水解生成HA-和H2A,据物料守恒可知c(Na+)═2[c(HA-)+c(A2-)+c(H2A)],故D正确;
故选D.
点评 本题考查了盐类水解、强弱电解质的区别、离子浓度大小的比较、电解质溶液中的物料守恒,题目难度不大.

练习册系列答案
相关题目
16.在某溶液中滴加HNO3酸化的BaCl2液,产生白色沉淀,该溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO32- | D. | 可能会有SO42-或Ag+或SO32- |
17.下列各组物质中的两种,互为同系物的是( )
| A. | O2和03 | B. | CH4和C3H8 | C. | 正丁烷和异丁烷 | D. | C2H4和C3H6 |
14.对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2中的氢元素被还原;⑤此反应中氧化产物与还原产物的原子个数之比是1:1,
上述判断中正确的是( )
上述判断中正确的是( )
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ④⑤ |
1.短周期元素X,Y,Z,W,Q在元素周期表中的相对位置如图所示.下列说法正确的是( )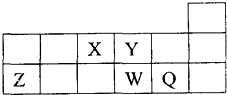

| A. | 离子Y2一和Z3+的核外电子数和核内质子数都相同 | |
| B. | 原子半径的大小顺序为:r(Z)>r(W)>r(Q)>r(Y)>r(X) | |
| C. | 最高价氧化物对应的水化物的酸性:W>Q | |
| D. | 元素X与元素Z的最高正化合价数值之和等于8 |
11.下列说法正确的是( )
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
18.一定温度时,在容积一定的密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI(g)?H2(g)+I2(g),下列叙述中一定表示达到化学平衡状态的是( )
| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
16.下列溶液物质的量浓度最大的是( )
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |