题目内容
2.甲溶液的PH=4,乙溶液的PH=1,则甲溶液与乙溶液中C(H+)之比是( )| A. | 1000 | B. | $\frac{1}{1000}$ | C. | 3 | D. | $\frac{1}{3}$ |
分析 溶液的pH=-lg[c(H+)],据此分别计算出pH=4、pH=1两溶液中氢离子浓度,然后计算出氢离子浓度之比.
解答 解:甲溶液的pH是4,溶液的c(H+)=10-4mol/L,乙溶液的pH是1,溶液的c(H+)=10-1mol/L,
则甲溶液与乙溶液的c(H+)之比为10-4mol/L:10-1mol/L=$\frac{1}{1000}$,
故选B.
点评 本题考查pH的简单计算,题目难度不大,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握pH的计算公式及其应用方法.

练习册系列答案
相关题目
12.下列有机物反应类型的判断正确的是( )
| A. | CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl(取代反应) | |
| B. | nH2C=CHCl→ (缩聚反应) (缩聚反应) | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O(氧化反应) | |
| D. | CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O(消去反应) |
13.下列有机物中,能发生消去反应生成两种烯烃的是( )
| A. | 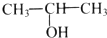 | B. | 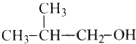 | C. | 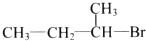 | D. | 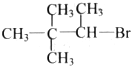 |
10.短周期主族金属元素甲、乙、丙在元素周期表中的相对位置如表所示,下列判断不正确的是( )
| 甲 | |
| 乙 | 丙 |
| A. | 原子半径:甲<乙 | |
| B. | 最外层电子数:甲>乙 | |
| C. | 最高价氧化物对应的水化物的碱性:丙>乙 | |
| D. | 金属性:丙<乙 |
17.下列各组物质中的两种,互为同系物的是( )
| A. | O2和03 | B. | CH4和C3H8 | C. | 正丁烷和异丁烷 | D. | C2H4和C3H6 |
7.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,Z元素可形成正一价离子.下列说法正确的是( )
| A. | Y元素的基态原子核外原子排布式为1s22s22p2 | |
| B. | Y元素与Z元素可以形成化合物Z2Y2 | |
| C. | X元素的基态原子中3个未成对电子的能量不相同 | |
| D. | X元素与Z元素可以形成离子化合物XZ3 |
14.对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2中的氢元素被还原;⑤此反应中氧化产物与还原产物的原子个数之比是1:1,
上述判断中正确的是( )
上述判断中正确的是( )
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ④⑤ |
11.下列说法正确的是( )
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
12.将质量相同的锌粉分别投入下列4个烧杯的溶液中,反应速率最快的是( )
| A. | 含1mol HCl 500mL | B. | 含36.5g HCl 500mL | ||
| C. | 2mol•L-1 HCl 500mL | D. | 2mol•L-1 H2SO4 250mL |