题目内容
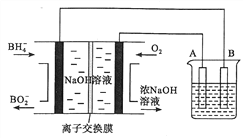
【题目】如图是一个化学过程的示意图.请回答下列问题: 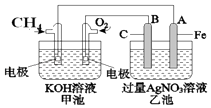
(1)甲池是装置(填“原电池”或“电解池”),B(石墨)电极的名称 是 .
(2)写出电极反应式: 通入CH4的电极;A(Fe)电极 .
(3)甲池中反应的离子方程式为 .
(4)乙池中反应的化学方程式为 .
(5)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中 A极的质量增加5.40g时: ①甲池中理论上消耗O2体积为(标准状况下);
②乙池中所得溶液的pH= .
【答案】
(1)原电池;阳极
(2)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O; Ag++e﹣═Ag
(3)CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(5)280mL;1
【解析】解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
B(石墨)与原电池的正极相连,所以电极的名称是阳极,所以答案是:原电池;阳极;(2)通入CH4的电极是原电池的负极发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;A(Fe)电极是电解池的阴极银离子发生还原反应,电极反应式为:Ag++e﹣═Ag,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,所以答案是:CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液,化学方程式为:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3,所以答案是:4AgNO3+2H2O
4Ag+O2↑+4HNO3,所以答案是:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量=
4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ![]() ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积=
×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= ![]() =280mL,所以答案是:280mL;
=280mL,所以答案是:280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,c= ![]() =
= ![]() =0.1mol/L,所以PH=1,所以答案是:1.
=0.1mol/L,所以PH=1,所以答案是:1.