题目内容
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
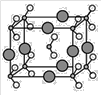
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
【答案】 [Ar]3d10 CN- sp 8 2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O或 4Cu2+ + 2PO![]() + 2NH3·H2O === Cu4O(PO4)2↓ + 2NH
+ 2NH3·H2O === Cu4O(PO4)2↓ + 2NH![]() + H2O SiCl4或SiF4或SO42-或PO
+ H2O SiCl4或SiF4或SO42-或PO![]() 等合理答案均可 三角双锥 12
等合理答案均可 三角双锥 12 ![]()
【解析】(1)Cu+的电子排布式[Ar]3d10;
(2)[Cu(CN)4]2-的配体为CN-,CN-是碳氮三键,故碳的杂化类型为sp,1个[Cu(CN)4]2-中含有四个配位键,CN-有一个σ键,故1个[Cu(CN)4]2-的σ键数目为8个;
(3)Na3PO4、CuSO4和NH3·H2O反应制取Cu4O(PO4)2,是一个非氧化还原反应,故其化学方程式为2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O;
(4)PCl5可电离成PCl4+、PCl6–两种离子,PCl4+为正四面体,PCl6–是正八面体,PCl5的立体构型为三角双锥形,PCl4+为5原子32价电子,与其互为等电子体的微粒有:SiCl4或SiF4或SO42-或PO![]() 等;
等;
(5)金属铜属于面心立方晶体,则铜的配位数为12,4r等于面对角线长,所以晶胞参数为:a=![]() pm,r=
pm,r= ![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
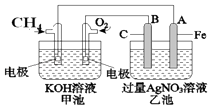
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
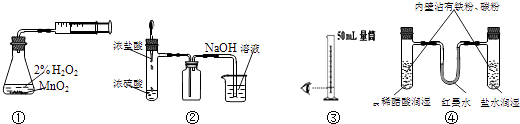
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 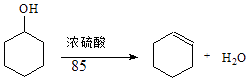
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
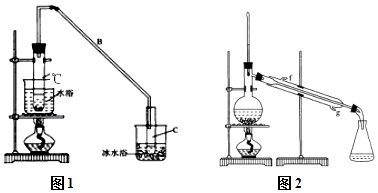
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品: ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从(填f或g)口进入,蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 .
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 .
A.酸性KMnO4溶液
B.用金属钠
C.测定沸点
D.溴的四氯化碳溶液.