��Ŀ����
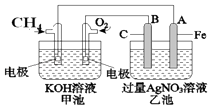
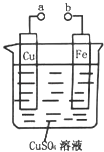
����Ŀ��NaBH4ȼ�ϵ�ؾ������۵�ѹ�ߡ������ܶȴ���ŵ㡣��֪�������ܶ�=���������ܣ�ȼ���������Ը�ȼ�ϵ��Ϊ��Դ��⾫��ͭ��װ����ͼ��ʾ������˵������ȷ����

A. ���ӽ���ĤӦΪ�����ӽ���Ĥ��Na+���������Ҽ���Ǩ��
B. ��ȼ�ϵ�صĸ�����ӦʽΪBH4-+8OH-��8e-��B![]() +6H2O
+6H2O
C. ��NaBH4 ȼ�ϵ�صĵ�ѹΪU������˵�ص������ܶ�Ϊ2.03��104UkJ��kg-1
D. ÿ����2.24 L O2(��״��)ʱ��A�缫����������12.8 g
���𰸡�D
�������������������������Ϣ��֪����ȼ�ϵ�ظ�������BH4-+8OH-��8e-��B![]() +6H2O����������2O2+8e-+4H2O=8OH-�����ڷ�Ӧ���Ҷ�������������Һ��Ũ�ȱ�����ӽ���ĤΪ�����ӽ���Ĥ��Na+������������Ǩ�ơ�A�缫Ϊ������B�缫Ϊ��������AΪ��ͭ��BΪ��ͭ��A. ���ӽ���ĤӦΪ�����ӽ���Ĥ��Na+���������Ҽ���Ǩ����A��ȷ��B. ��ȼ�ϵ�صĸ�����ӦʽΪBH4-+8OH-��8e-��B
+6H2O����������2O2+8e-+4H2O=8OH-�����ڷ�Ӧ���Ҷ�������������Һ��Ũ�ȱ�����ӽ���ĤΪ�����ӽ���Ĥ��Na+������������Ǩ�ơ�A�缫Ϊ������B�缫Ϊ��������AΪ��ͭ��BΪ��ͭ��A. ���ӽ���ĤӦΪ�����ӽ���Ĥ��Na+���������Ҽ���Ǩ����A��ȷ��B. ��ȼ�ϵ�صĸ�����ӦʽΪBH4-+8OH-��8e-��B![]() +6H2O��B��ȷ��C. 1mol NaBH4������Ϊ38g��1mol NaBH4��ȫ��Ӧ��ת��8mol���ӣ�1�����ӵĵ���Ϊ1.6
+6H2O��B��ȷ��C. 1mol NaBH4������Ϊ38g��1mol NaBH4��ȫ��Ӧ��ת��8mol���ӣ�1�����ӵĵ���Ϊ1.6![]() ����NaBH4 ȼ�ϵ�صĵ�ѹΪU������˵�ص������ܶ�Ϊ
����NaBH4 ȼ�ϵ�صĵ�ѹΪU������˵�ص������ܶ�Ϊ![]() 2.03��104UJ��g-1=2.03��104UkJ��kg-1��C��ȷ��D. ÿ����2.24 L O2(��״��)ʱ��������0.1mol�����������ת��0.4mol��A�缫�Ǵ�ͭ����ͭ�ܽ��������б�ͭ���õ����ʽ�������п�ȣ�Ҳ�ܽ⣬��������A�缫�����������D����ȷ������ѡD��
2.03��104UJ��g-1=2.03��104UkJ��kg-1��C��ȷ��D. ÿ����2.24 L O2(��״��)ʱ��������0.1mol�����������ת��0.4mol��A�缫�Ǵ�ͭ����ͭ�ܽ��������б�ͭ���õ����ʽ�������п�ȣ�Ҳ�ܽ⣬��������A�缫�����������D����ȷ������ѡD��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�