题目内容
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡.
(1)氨水是中学常见的碱溶液 ①下列事实可证明NH3H2O是弱碱的是(填字母序号).
A.常温下,0.1molL﹣1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0.1molL﹣1氯化铵溶液的pH为5
D. 铵盐受热易分解
②下列方法中,可以使氨水电离程度增大的是(填字母序号).
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸 用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.
①滴定醋酸的曲线是(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字): c(H+)﹣c(NH3﹒H2O)=mol/L.
(4)铵盐和氯化银是中学常见盐 ①0.1molL﹣1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较(填溶质的化学式)溶液中NH4+的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl﹣(aq)
在25℃时,AgCl的Ksp=1.8×10﹣10 . 现将足量AgCl分别放入下列液体中:
①100mL蒸馏水
②100mL 0.3molL﹣1AgNO3溶液
③100mL 0.1molL﹣1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为(填序号).
【答案】
(1)AC; BC
(2)I;0.1mol?L﹣1醋酸溶液;<; c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣)
(3)10﹣8
(4)(NH4)2Fe(SO4)2; NH4+和Fe2+都水解呈酸性,水解相互抑制;②>①>③
【解析】解:(1)①A.常温下,0.1molL﹣1氨水pH为11,溶液呈酸性,说明一水合氨部分电离,则说明一水合氨是弱电解质,故A正确;
B.氨水和氯化亚铁反应生成氢氧化亚铁沉淀,说明一水合氨是碱,但不能说明一水合氨部分电离,所以不能说明是弱电解质,故B错误;
C.常温下,0.1mol/L的氯化铵溶液pH约为5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故C正确;
D.铵盐受热易分解说明铵盐不稳定,不能说明一水合氨部分电离,则不能说明一水合氨是弱电解质,故D错误;
所以答案是:AC;
②A.加入少量氯化铁固体,会消耗氢氧根离子,则促进一水合氨的电离,电离程度增大,故A正确;
B.通入氨气,氨水的浓度增大,电离程度减小,故B错误;
C.加入少量氯化铵固体,铵根离子浓度增大,抑制氨水的电离,电离程度减小,故C错误;
D.加水稀释,促进一水合氨的电离,电离程度增大,故D正确;
所以答案是:AD;(2)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
所以答案是:I;
②0.1molL﹣1 NaOH溶液、0.1molL﹣1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 molL﹣1醋酸溶液,所以答案是:0.1molL﹣1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2,所以答案是:<;
④用0.1molL﹣1 NaOH溶液10mL和溶液体积为20.00mL0.1molL﹣1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣),所以答案是:c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣);(3)根据电荷守恒得c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),物料守恒c(NH4+)+c(NH3﹒H2O)=0.1mol/L=c(Cl﹣),
所以c(H+)﹣c(NH3﹒H2O)=c(OH﹣)=10﹣8mol/L,
所以答案是:10﹣8;(4)①:(NH4)2Fe(SO4)2中NH4+和Fe2+都水解呈酸性,水解相互抑制,因此(NH4)2Fe(SO4)2中NH4+的水解程度(NH4)2SO4的要小,(NH4)2Fe(SO4)2比(NH4)2SO4的c(NH4+)大.
所以答案是:(NH4)2Fe(SO4)2;NH4+和Fe2+都水解呈酸性,水解相互抑制;
②氯化银饱和溶液中存在沉淀溶解平衡:AgCl(s)Ag+(ag)+Cl﹣(ag),溶液中c(Ag+)或c(Cl﹣)浓度越大,AgCl溶解度越小,
①100mL蒸馏水中c(Ag+)= ![]() mol/L;
mol/L;
②100mL 0.3molL﹣1AgNO3溶液,c(Ag+)=0.3mol/L;
③100mL0.1molL﹣1MgCl2溶液中,c(Cl﹣)=0.2mol/L,c(Ag+)=9×10﹣10mol/L;
c(Ag+)由大到小的顺序为②>①>③,
所以答案是:②>①>③.

【题目】下表中根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X一定是浓盐酸 |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2的强 |
C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀,后溶液又变红 | Y中一定含有SO |
D | C2H5OH与浓硫酸混合后加热到170 ℃ | 制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
A. A B. B C. C D. D
【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
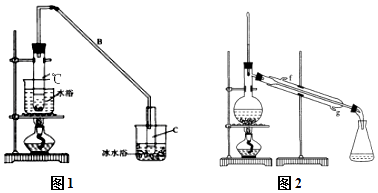
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 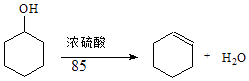
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品: ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从(填f或g)口进入,蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 .
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 .
A.酸性KMnO4溶液
B.用金属钠
C.测定沸点
D.溴的四氯化碳溶液.