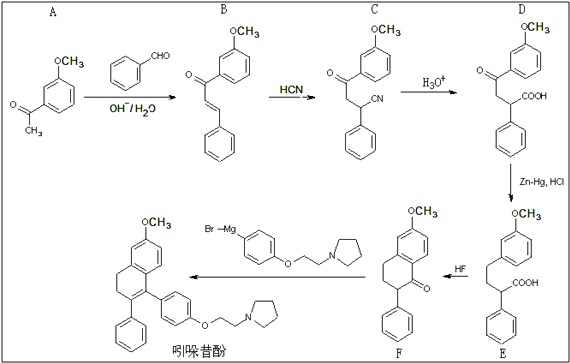
题目内容
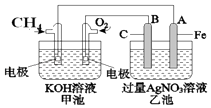
【题目】用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色. 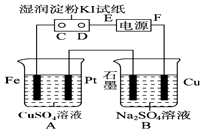
(1)E为电源的极,Fe为极.
(2)A中发生反应的离子方程式为 , B中发生反应的化学方程式为 .
(3)在B中观察到的现象是
(4)若此电源为铅蓄电池,电池总反应式为: Pb+PbO2+4H++2SO42﹣ ![]() PbSO4+2H2O
PbSO4+2H2O
则放电时:正极的电极反应式是;充电时:阴极的电极反应式是;当外电路通过1mol电子时,理论上负极板的质量增加g,此时若要使A池中的溶液复原,应加入g的CuO固体.
【答案】
(1)负;阴
(2)2Cu2++2H2O ![]() 2Cu+4H++O2↑;2Cu+2H2O
2Cu+4H++O2↑;2Cu+2H2O ![]() 2Cu(OH)2+H2↑
2Cu(OH)2+H2↑
(3)铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)PbO2+2e﹣+4H++SO42﹣=PbSO4+2H2O; PbSO4+2e﹣=Pb+SO42﹣;40;40
【解析】解:通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,铁作阴极,铂丝作阳极,电解硫酸铜溶液时,阴极上铜离子放电,阳极上氢氧根离子放电,(1)E为电源的 负极,铁电源负极相连,所以Fe为阴极,
所以答案是:负;阴;(2)A池中为惰性电极电解硫酸铜溶液,反应的离子方程式为:2Cu2++2H2O ![]() 2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为:2Cu+2H2O
2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为:2Cu+2H2O ![]() 2Cu(OH)2+H2↑,
2Cu(OH)2+H2↑,
所以答案是:2Cu2++2H2O ![]() 2Cu+4H++O2↑;2Cu+2H2O
2Cu+4H++O2↑;2Cu+2H2O ![]() 2Cu(OH)2+H2↑;(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成,
2Cu(OH)2+H2↑;(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成,
所以答案是:铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;(4)电池总反应式为:Pb+PbO2+4H++2SO42﹣2PbSO4+2H2O,负极电解反应为:Pb﹣2e﹣+SO42﹣=PbSO4 ,正极电极反应为:PbO2+2e﹣+4H++2SO42﹣=PbSO4+2H2O;放电时:正极的电极反应式是PbO2+2e﹣+4H++2SO42﹣=PbSO4+2H2O;
当外电路通过1mol电子时,依据电子守恒计算理论上负极板增加质量增为:0.5mol×303g/mol﹣0.5mol×207g/mol=48g,此时若要使A池中的溶液复原,应加入0.5molCuO固体,其质量为:0.5mol×80g/mol=40g,
所以答案是:PbO2+2e﹣+4H++2SO42﹣=PbSO4+2H2O;PbSO4+2e﹣=Pb+SO42﹣;48;40.