题目内容
16.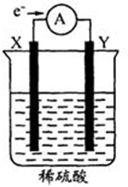 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |
分析 在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,根据电子流向知,X是负极、Y是正极,
A.电流从正极流向负极;
B.原电池中,易失电子的电极为负极;
C.负极上发生氧化反应、正极上发生还原反应;
D.电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答 解:在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,根据电子流向知,X是负极、Y是正极,
A.电流从正极流向负极,所以外电路的电流方向为:Y→导线→X,故A错误;
B.原电池中,易失电子的电极为负极,若两电极都是金属,X易失电子,则它们的活动性顺序可能为X>Y,故B正确;
C.负极上失电子发生氧化反应、正极上得电子发生还原反应,所以X电极发生氧化反应、Y电极发生还原反应,故C错误;
D.电解质溶液中阳离子向正极移动、阴离子向负极移动,则硫酸根离子向负极X电极移动,故D错误;
故选B.
点评 本题考查了原电池原理,根据电子流向判断正负极,再结合电极上发生的反应、离子移动方向分析解答,注意离子移动方向,为易错点.

练习册系列答案
相关题目
2.在实验室中,下列除去杂质的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取溴 | |
| B. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入NaOH溶液中振荡,静置,分液 | |
| C. | 乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 | |
| D. | 乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气 |
11.运用元素周期律分析下面推断,其中错误的是( )
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
1.常温下,下列有关离子浓度及pH大小的比较,正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
5.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
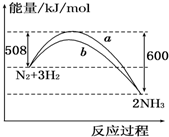

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.
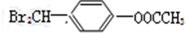

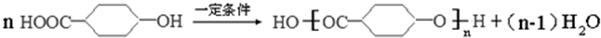
 中任意一种
中任意一种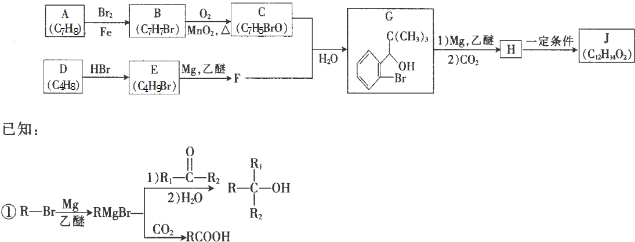
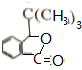 .
.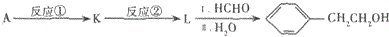
 .
.