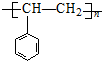
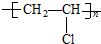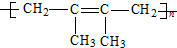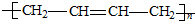题目内容
1.常温下,下列有关离子浓度及pH大小的比较,正确的是( )| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
分析 A.铵根离子水解程度越大,溶液中铵根离子浓度越小,亚铁离子抑制了铵根离子水解、碳酸根离子促进了铵根离子的水解,据此判断铵根离子浓度相等时该溶液浓度大小;
B.常温下由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH-),结合电荷守恒判断各离子浓度大小;
C.对于化学式组成相似的,溶度积常数越大,溶解度也越大,若难溶物的组成形式不同,该关系不一定满足,需要通过计算判断;
D.常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,结合混合液中的电荷守恒、物料守恒进行计算.
解答 解:A.硫酸亚铁铵中,亚铁离子对铵根离子的水解起到抑制作用;碳酸铵中,碳酸根对铵根离子的水解起到促进作用,硫酸根离子不影响铵根离子的水解,所以三种溶液中NH4+浓度相同时,溶液浓度大小为:②>③>①,故A错误;
B.由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.对于化学式组成相似的,溶度积常数越大,溶解度也越大,由于A(OH)m和B(OH)n的化学式组成形式不同,所以不能直接根据溶解度大小判断其溶度积,故C错误;
D.常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知:①c(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:②2c(Na+)=c(CH3COOH)+c(CH3COO-),①×2+②可得:c(CH3COO-)-c(CH3COOH)=2(c(H+)-c(OH-))=2×(10-4-10-10) mol/L,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,试题涉及盐的水解原理、难溶物溶度积的应用、离子浓度大小比较等知识,注意掌握盐的水解原理及其影响,明确电荷守恒、物料守恒在判断离子浓度大小中的应用方法.

| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 现象或事实 | 解释 |
| A | 热的纯碱溶液去油污效果 更好 | 温度升高,增大了油脂在碳 酸钠溶液中的溶解度 |
| B | 生活中的铝制品经久耐用 | 常温时铝不与氧气反应 |
| C | 氢氧化铁胶体通直流电,阴极颜色变深 | 氛氧化铁胶体带正电荷,在电场力的作用下,胶体向阴极迁移 |
| D | 二氧化破用作通讯光缆 | 二氧化硅对光信号有良好的 传输性能 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 铝热反应 |
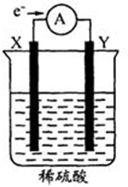 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
| A. | 干冰、二氧化硅、金刚石 | B. | 氧化钠、金刚石、氯化氢 | ||
| C. | 碘、石墨、氯化钠 | D. | 二氧化硅、金刚石、晶体硼 |